Escisión del éter - Ether cleavage
La escisión del éter se refiere a reacciones de sustitución química que conducen a la escisión de los éteres . Debido a la alta estabilidad química de los éteres, la ruptura del enlace CO es poco común en ausencia de reactivos especializados o en condiciones extremas.
En química orgánica , la escisión del éter es una reacción de sustitución nucleofílica catalizada por ácido . Dependiendo del éter específico, la escisión puede seguir mecanismos S N 1 o S N 2 . Distinguir entre ambos mecanismos requiere considerar los efectos inductivos y mesoméricos que podrían estabilizar o desestabilizar un carbocatión potencial en la vía S N 1 . El uso de ácidos hidrohálicos aprovecha el hecho de que estos agentes pueden protonar el átomo de oxígeno del éter y también proporcionar un anión haluro como nucleófilo adecuado . Sin embargo, como los éteres muestran una basicidad similar a la de los alcoholes (pK a de aproximadamente 16), el equilibrio de protonación se encuentra en el lado del éter no protonado y la escisión suele ser muy lenta a temperatura ambiente.
Los éteres se pueden escindir mediante agentes fuertemente básicos, por ejemplo, compuestos de organolitio. Los éteres cíclicos son especialmente susceptibles de escisión, pero los éteres acíclicos también pueden escindirse.
Escisión del éter S N 1
El mecanismo unimolecular S N 1 procede a través de un carbocatión (siempre que el carbocatión pueda estabilizarse adecuadamente). En el ejemplo, el átomo de oxígeno en metil terc- butil éter está protonado reversiblemente. El ion oxonio resultante luego se descompone en metanol y un catión terc -butilo relativamente estable . Este último es luego atacado por un haluro de nucleófilo (aquí bromuro), produciendo bromuro de terc- butilo .
Mecanismo
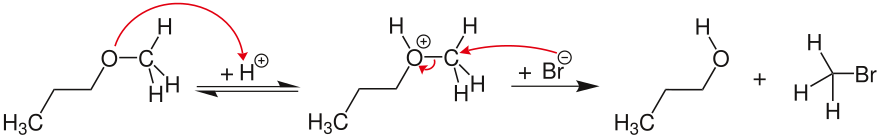
Escisión del éter S N 2
Si el carbocatión potencial no puede estabilizarse, la escisión del éter sigue un mecanismo S N 2 bimolecular y concertado . En el ejemplo, el oxígeno del éter está protonado de forma reversible. El ion haluro (en este caso bromuro) ataca nucleofílicamente al átomo de carbono estéricamente menos impedido, formando así bromuro de metilo y 1-propanol .
Mecanismo
Otros factores
La escisión del éter S N 1 es generalmente más rápida que la escisión del éter S N 2. Sin embargo, las reacciones que requerirían la formación de carbocationes inestables ( metilo , vinilo , arilo o carbono primario ) proceden a través del mecanismo S N 2. El ácido hidrohálico también juega un papel importante, ya que la velocidad de reacción es mayor con ácido yodhídrico que con ácido bromhídrico . El ácido clorhídrico solo reacciona en condiciones más rigurosas. La razón radica en la mayor acidez de los ácidos hidrohálicos más pesados, así como en la mayor nucleofilia de la base conjugada respectiva . El fluoruro no es lo suficientemente nucleofílico para permitir el uso de ácido fluorhídrico para escindir éteres en medios próticos. Independientemente del ácido hidrohálico que se utilice, la velocidad de reacción es comparativamente baja, por lo que se requiere el calentamiento de la mezcla de reacción.
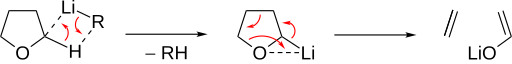
Escisión del éter con agentes organometálicos
Mecanismo
La escisión básica del éter se induce mediante desprotonación en la posición α. El éter luego se descompone en un alqueno y un alcóxido . Los éteres cíclicos permiten una escisión concertada especialmente rápida , como se ve para el THF :
Los éteres acíclicos desprotonados realizan la eliminación del hidruro beta , formando un éter olefínico. El hidruro formado luego ataca el resto olefínico en la posición α al oxígeno del éter, liberando el alcóxido.
Impacto
Los agentes organometálicos a menudo se manipulan en disolventes etéricos, que se coordinan con los centros metálicos y, por lo tanto, mejoran la reactividad de los restos orgánicos. Aquí, la escisión del éter plantea un problema, ya que no solo descompone el disolvente, sino que también consume el agente organometálico. Por lo tanto, las reacciones con agentes organometálicos se realizan típicamente a bajas temperaturas ( -78 ° C ). A estas temperaturas, la desprotonación se inhibe cinéticamente y es lenta en comparación con muchas reacciones que se pretende que tengan lugar.
Literatura
- Paula Y. Bruice: Química Orgánica , Prentice Hall. ISBN 978-0321697684 .
Referencias
- ^ Ranu, BC; Bhar, S. (1996). "Desalquilación de éteres. Una revisión". Org. Deberes. Proc. Int . 28 (4): 371-409. doi : 10.1080 / 00304949609356549 .Mantenimiento de CS1: utiliza el parámetro de autores ( enlace )
- ^ Christoph Elschenbroich: Organometálicos, tercero, edición completamente revisada y extendida 2006, Wiley-VCH Weinheim, Alemania. ISBN 978-3-527-29390-2 .