Descubrimiento del neutrón - Discovery of the neutron

El descubrimiento del neutrón y sus propiedades fue fundamental para los extraordinarios desarrollos de la física atómica en la primera mitad del siglo XX. A principios de siglo, Ernest Rutherford desarrolló un modelo crudo del átomo, basado en el experimento de la lámina de oro de Hans Geiger y Ernest Marsden . En este modelo, los átomos tenían su masa y carga eléctrica positiva concentrada en un núcleo muy pequeño . Hacia 1920 se habían descubierto los isótopos químicos , se había determinado que las masas atómicas eran (aproximadamente) múltiplos enteros de la masa del átomo de hidrógeno , y se había identificado el número atómico como la carga en el núcleo. A lo largo de la década de 1920, se consideró que el núcleo estaba compuesto por combinaciones de protones y electrones , las dos partículas elementales conocidas en ese momento, pero ese modelo presentaba varias contradicciones experimentales y teóricas.
La naturaleza esencial del núcleo atómico se estableció con el descubrimiento del neutrón por James Chadwick en 1932 y la determinación de que se trataba de una nueva partícula elemental, distinta del protón.
El neutrón sin carga fue inmediatamente explotado como un nuevo medio para sondear la estructura nuclear, lo que condujo a descubrimientos como la creación de nuevos elementos radiactivos por irradiación de neutrones (1934) y la fisión de átomos de uranio por neutrones (1938). El descubrimiento de la fisión condujo a la creación tanto de la energía nuclear y las armas nucleares para el final de la Segunda Guerra Mundial. Se suponía que tanto el protón como el neutrón eran partículas elementales hasta la década de 1960, cuando se determinó que eran partículas compuestas construidas a partir de quarks .
Descubrimiento de radiactividad
A principios del siglo XX, el vigoroso debate sobre la existencia de los átomos aún no se había resuelto. Filósofos como Ernst Mach y Wilhelm Ostwald negaron que los átomos fueran reales, viéndolos como una construcción matemática conveniente, mientras que científicos como Arnold Sommerfeld y Ludwig Boltzmann vieron que las teorías físicas requerían la existencia de átomos.
La radiactividad fue descubierta en 1896 por el científico francés Henri Becquerel , mientras trabajaba con materiales fosforescentes . En 1898, Ernest Rutherford en Laboratorio Cavendish distingue dos tipos de radiactividad, rayos alfa y rayos beta , que diferían en su capacidad para penetrar, o de viaje en, objetos ordinarios o gases. Dos años más tarde, Paul Villard descubrió los rayos gamma , que poseían un poder aún más penetrante. Estas radiaciones pronto se identificaron con partículas conocidas: Walter Kaufmann demostró en 1902 que los rayos beta eran electrones ; Rutherford y Thomas Royds demostraron en 1907 que los rayos alfa eran iones de helio ; y Rutherford y Edward Andrade en 1914 demostraron que los rayos gamma eran radiación electromagnética, es decir, una forma de luz . Estas radiaciones también habían sido identificadas como emanadas de átomos, por lo que proporcionaban pistas sobre los procesos que ocurren dentro de los átomos. Por el contrario, las radiaciones también se reconocieron como herramientas que podrían explotarse en experimentos de dispersión para sondear el interior de los átomos.
El experimento de la lámina de oro y el descubrimiento del núcleo atómico
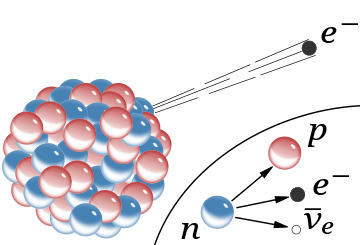
β-
radiación, la emisión de un electrón rápido del núcleo (se omite el antineutrino que lo acompaña). En el modelo de Rutherford para el núcleo, las esferas rojas eran protones con carga positiva y las esferas azules eran protones estrechamente unidos a un electrón sin carga neta.
El recuadro muestra la desintegración beta de un neutrón libre como se entiende hoy; en este proceso se crean un electrón y un antineutrino.
En la Universidad de Manchester entre 1908 y 1913, Rutherford dirigió a Hans Geiger y Ernest Marsden en una serie de experimentos para determinar qué sucede cuando las partículas alfa se dispersan de la hoja de metal. Ahora llamado el experimento de la lámina de oro de Rutherford , o el experimento de Geiger-Marsden, estas mediciones hicieron el extraordinario descubrimiento de que las partículas alfa ocasionalmente se dispersarían en un ángulo alto al pasar a través de una delgada lámina de oro. La dispersión indicó que las partículas alfa fueron desviadas por un componente pequeño, pero denso, de átomos. Sobre la base de estas mediciones, en 1911 Rutherford tenía claro que el átomo consistía en un núcleo pequeño y masivo con carga positiva rodeado por una nube mucho más grande de electrones cargados negativamente . Se requirió la masa atómica concentrada para proporcionar la desviación observada de las partículas alfa, y Rutherford desarrolló un modelo matemático que explica la dispersión.
El modelo de Rutherford fue muy influyente, motivó el modelo de Bohr para los electrones que orbitaban el núcleo en 1913 y finalmente condujo a la mecánica cuántica a mediados de la década de 1920.
Descubrimiento de isótopos
Simultáneamente con el trabajo de Rutherford, Geiger y Marsden, el radioquímico Frederick Soddy de la Universidad de Glasgow estaba estudiando problemas relacionados con la química en materiales radiactivos. Soddy había trabajado con Rutherford en radioactividad en la Universidad McGill . Para 1910, se habían identificado alrededor de 40 elementos radiactivos diferentes, conocidos como radioelementos , entre el uranio y el plomo, aunque la tabla periódica solo permitía 11 elementos. Soddy y Kazimierz Fajans encontraron de forma independiente en 1913 que un elemento que experimenta una desintegración alfa producirá un elemento dos lugares a la izquierda en el sistema periódico y un elemento que experimenta una desintegración beta producirá un elemento un lugar a la derecha en el sistema periódico. Además, los radioelementos que residen en los mismos lugares del sistema periódico son químicamente idénticos. Soddy llamó a estos elementos químicamente idénticos isótopos . Por su estudio de la radiactividad y el descubrimiento de isótopos, Soddy recibió el Premio Nobel de Química de 1921.
A partir del trabajo de JJ Thomson sobre la desviación de átomos cargados positivamente por campos eléctricos y magnéticos, Francis Aston construyó el primer espectrógrafo de masas en el Laboratorio Cavendish en 1919. Su objetivo, que logró fácilmente, era separar los dos isótopos de neón ,20
Nordeste
y 22
Nordeste
. Aston descubrió que las masas de todas las partículas son números enteros (la regla de los números enteros ): es decir, las masas de todos los isótopos son múltiplos enteros de la masa del átomo de hidrógeno . En estas mediciones, Aston calculó arbitrariamente sus masas en relación con el oxígeno-16 , que consideró que tenía una masa de exactamente 16. (Hoy en día, la unidad de masa atómica (uma) es relativa al carbono-12 ). Irónicamente, la única excepción a esto. La regla era el propio hidrógeno, que tenía un valor de masa de 1,008. El exceso de masa era pequeño, pero muy fuera de los límites de la incertidumbre experimental. Aston y otros se dieron cuenta rápidamente de que la discrepancia se debe a la energía de enlace de los átomos, es decir, la masa de varios átomos de hidrógeno unidos en un solo átomo debe ser menor que la suma de las masas de los átomos de hidrógeno separados. El trabajo de Aston sobre isótopos le valió el Premio Nobel de Química en 1922 por el descubrimiento de isótopos en un gran número de elementos no radiactivos y por su enunciación de la regla de los números enteros. Al observar el reciente descubrimiento de Aston de la energía de enlace nuclear, en 1920 Arthur Eddington sugirió que las estrellas pueden obtener su energía fusionando hidrógeno (protones) en helio y que los elementos más pesados pueden formarse en las estrellas.
Número atómico y ley de Moseley
Rutherford y otros habían notado la disparidad entre la masa de un átomo, calculada en unidades de masa atómica, y la carga aproximada requerida en el núcleo para que funcione el modelo de Rutherford. La carga requerida del núcleo atómico era generalmente aproximadamente la mitad de su masa atómica. Antonius van den Broek planteó audazmente la hipótesis de que la carga requerida, denotada por Z , no era la mitad del peso atómico de los elementos, sino que era exactamente igual a la posición ordinal del elemento en la tabla periódica . En ese momento, no se sabía que las posiciones de los elementos en la tabla periódica tuvieran ningún significado físico. Sin embargo, si los elementos se ordenaban basándose en el aumento de la masa atómica, se mostraba periodicidad en las propiedades químicas. Sin embargo, fueron evidentes excepciones a esta periodicidad, como el cobalto y el níquel.
En la Universidad de Manchester en 1913 Henry Moseley discutió el nuevo modelo de Bohr del átomo con el visitante Bohr. El modelo tuvo en cuenta el espectro de emisión electromagnética del átomo de hidrógeno, y Moseley y Bohr se preguntaron si los espectros de emisión electromagnética de elementos más pesados como el cobalto y el níquel seguirían su orden por peso o por su posición en la tabla periódica. En 1913-1914, Moseley probó la cuestión de forma experimental utilizando técnicas de difracción de rayos X. Se encontró que la intensa más corta longitud de onda de línea en el espectro de rayos X de un elemento particular, conocido como el K-alfa línea, estaba relacionado con la posición del elemento en la tabla periódica, es decir, su número atómico, Z . De hecho, Moseley introdujo esta nomenclatura. Moseley descubrió que las frecuencias de la radiación estaban relacionadas de forma sencilla con el número atómico de los elementos para una gran cantidad de elementos.
En un año se observó que la ecuación para la relación, ahora llamada ley de Moseley , podría explicarse en términos del modelo de Bohr de 1913, con supuestos adicionales razonables sobre la estructura atómica en otros elementos. El resultado de Moseley, según el relato posterior de Bohr, no solo estableció el número atómico como una cantidad experimental mensurable, sino que le dio un significado físico como la carga positiva en el núcleo atómico. Los elementos podrían ordenarse en el sistema periódico en orden de número atómico, en lugar de peso atómico. El resultado unió la organización de la tabla periódica, el modelo de Bohr para el átomo y el modelo de Rutherford para la dispersión alfa de los núcleos. Fue citado por Rutherford, Bohr y otros como un avance crítico en la comprensión de la naturaleza del núcleo atómico.
La investigación adicional en física atómica fue interrumpida por el estallido de la Primera Guerra Mundial . Moseley murió en 1915 en la batalla de Gallipoli , mientras que el estudiante de Rutherford, James Chadwick, estuvo internado en Alemania durante la guerra, 1914-1918. En Berlín, se interrumpió el trabajo de investigación de Lise Meitner y Otto Hahn sobre la determinación de las cadenas de desintegración radiactiva del radio y el uranio mediante una separación química precisa. Meitner pasó gran parte de la guerra trabajando como radiólogo y técnico médico en rayos X cerca del frente austriaco, mientras que Hahn, un químico , trabajó en la investigación de la guerra con gas venenoso .
Átomo de Rutherford
En 1920, Rutherford dio una conferencia panadera en la Royal Society titulada "Constitución nuclear de los átomos", un resumen de experimentos recientes sobre núcleos atómicos y conclusiones sobre la estructura de los núcleos atómicos. En 1920, se asumió ampliamente la existencia de electrones dentro del núcleo atómico. Se asumió que el núcleo constaba de núcleos de hidrógeno en número igual a la masa atómica. Pero dado que cada núcleo de hidrógeno tenía carga +1, el núcleo requería un número menor de "electrones internos" cada uno de carga -1 para dar al núcleo su carga total correcta. La masa de los protones es aproximadamente 1800 veces mayor que la de los electrones, por lo que la masa de los electrones es incidental en este cálculo. Dicho modelo era coherente con la dispersión de partículas alfa de núcleos pesados, así como con la carga y masa de los muchos isótopos que se habían identificado. Había otras motivaciones para el modelo protón-electrón. Como señaló Rutherford en ese momento, "Tenemos fuertes razones para creer que los núcleos de los átomos contienen electrones así como cuerpos cargados positivamente ...", es decir, se sabía que la radiación beta eran electrones emitidos por el núcleo.
En esa conferencia, Rutherford conjeturó la existencia de nuevas partículas. Se sabía que la partícula alfa era muy estable y se suponía que conservaba su identidad dentro del núcleo. Se suponía que la partícula alfa consistía en cuatro protones y dos electrones estrechamente ligados para darle +2 carga y masa 4. En un artículo de 1919, Rutherford había informado del aparente descubrimiento de una nueva partícula doblemente cargada de masa 3, denominada X ++, interpretado como formado por tres protones y un electrón estrechamente ligado. Este resultado sugirió a Rutherford la probable existencia de dos nuevas partículas: una de dos protones con un electrón estrechamente ligado, y otra de un protón y un electrón íntimamente ligado. Más tarde se determinó que la partícula X ++ tenía una masa 4 y era solo una partícula alfa de baja energía. Sin embargo, Rutherford había conjeturado la existencia del deuterón, una partícula de carga +1 de masa 2, y el neutrón, una partícula neutra de masa 1. El primero es el núcleo de deuterio , descubierto en 1931 por Harold Urey . La masa de la hipotética partícula neutra sería un poco diferente de la del protón. Rutherford determinó que tal partícula de carga cero sería difícil de detectar con las técnicas disponibles.
En 1921, Rutherford y William Harkins habían llamado de forma independiente a la partícula sin carga el neutrón , mientras que por esa misma época se adoptó la palabra protón para el núcleo de hidrógeno. Aparentemente, el neutrón se construyó a partir de la raíz latina de neutro y la terminación griega -on (por imitación de electrón y protón ). Sin embargo, las referencias a la palabra neutrón en relación con el átomo se pueden encontrar en la literatura ya en 1899.
Rutherford y Chadwick comenzaron inmediatamente un programa experimental en el Laboratorio Cavendish de Cambridge para buscar el neutrón. Los experimentos continuaron a lo largo de la década de 1920 sin éxito.
La conjetura de Rutherford no fue ampliamente aceptada. En su monografía de 1931 sobre la Constitución de los núcleos atómicos y la radiactividad , George Gamow , entonces en el Instituto de Física Teórica de Copenhague, no mencionó el neutrón. En el momento de sus mediciones de 1932 en París que conducirían al descubrimiento del neutrón, Irène Joliot-Curie y Frédéric Joliot desconocían la conjetura.
Problemas de la hipótesis de los electrones nucleares
A lo largo de la década de 1920, los físicos asumieron que el núcleo atómico estaba compuesto por protones y "electrones nucleares". Bajo esta hipótesis, el núcleo de nitrógeno-14 ( 14 N) estaría compuesto por 14 protones y 7 electrones, por lo que tendría una carga neta de +7 unidades de carga elemental y una masa de 14 unidades de masa atómica. Este núcleo también estaría orbitado por otros 7 electrones, denominados "electrones externos" por Rutherford, para completar el átomo de 14 N. Sin embargo, pronto se hicieron evidentes los problemas con la hipótesis.
Ralph Kronig señaló en 1926 que la estructura hiperfina observada de los espectros atómicos era incompatible con la hipótesis protón-electrón. Esta estructura es causada por la influencia del núcleo en la dinámica de los electrones en órbita. Los momentos magnéticos de los supuestos "electrones nucleares" deberían producir divisiones de líneas espectrales hiperfinas similares al efecto Zeeman , pero no se observaron tales efectos. Parecía que el momento magnético del electrón se desvanecía cuando estaba dentro del núcleo.
Durante una visita a la Universidad de Utrecht en 1928, Kronig se enteró de un aspecto sorprendente del espectro rotacional del N 2 + . La medición de precisión realizada por Leonard Ornstein , director del Laboratorio de Física de Utrecht, mostró que el giro del núcleo de nitrógeno debe ser igual a uno. Sin embargo, si el núcleo de nitrógeno-14 ( 14 N) estaba compuesto por 14 protones y 7 electrones, un número impar de partículas de espín-1/2, entonces el espín nuclear resultante debería ser medio entero. Por lo tanto, Kronig sugirió que quizás "los protones y los electrones no conservan su identidad en la medida en que lo hacen fuera del núcleo".
Las observaciones de los niveles de energía rotacional de las moléculas diatómicas utilizando la espectroscopía Raman por Franco Rasetti en 1929 fueron inconsistentes con las estadísticas esperadas de la hipótesis protón-electrón. Rasetti obtuvo espectros de banda para moléculas de H 2 y N 2 . Mientras que las líneas de ambas moléculas diatómicas mostraron una alternancia de intensidad entre la luz y la oscuridad, el patrón de alternancia del H 2 es opuesto al del N 2 . Después de analizar cuidadosamente estos resultados experimentales, los físicos alemanes Walter Heitler y Gerhard Herzberg demostraron que los núcleos de hidrógeno obedecen a las estadísticas de Fermi y los núcleos de nitrógeno obedecen a las estadísticas de Bose. Sin embargo, un resultado entonces inédito de Eugene Wigner mostró que un sistema compuesto con un número impar de partículas de spin-1/2 debe obedecer las estadísticas de Fermi; un sistema con un número par de partículas spin-1/2 obedece a las estadísticas de Bose. Si el núcleo de nitrógeno tuviera 21 partículas, debería obedecer las estadísticas de Fermi, al contrario de lo que es cierto. Así, Heitler y Herzberg concluyeron: "el electrón en el núcleo ... pierde su capacidad para determinar las estadísticas del núcleo".
La paradoja de Klein , descubierta por Oskar Klein en 1928, presentó más objeciones de la mecánica cuántica a la noción de un electrón confinado dentro de un núcleo. Derivado de la ecuación de Dirac , esta paradoja clara y precisa sugirió que un electrón que se acerca a una barrera de alto potencial tiene una alta probabilidad de atravesar la barrera mediante un proceso de creación de pares . Aparentemente, un electrón no podría estar confinado dentro de un núcleo por ningún pozo potencial. El significado de esta paradoja se debatió intensamente en ese momento.
Alrededor de 1930 se reconoció en general que era difícil conciliar el modelo protón-electrón para núcleos con la relación de incertidumbre de Heisenberg de la mecánica cuántica. Esta relación, Δ x ⋅Δ p ≥ 1 ⁄ 2 ħ , implica que un electrón confinado a una región del tamaño de un núcleo atómico típicamente tiene una energía cinética no menor a 40 MeV, que es mayor que la energía observada de las partículas beta emitidas. desde el núcleo. Dicha energía también es mucho mayor que la energía de enlace de los nucleones, que Aston y otros habían demostrado ser inferior a 9 MeV por nucleón.
En 1927, Charles Ellis y W. Wooster del Laboratorio Cavendish midieron las energías de los electrones de desintegración β. Descubrieron que la distribución de energías de cualquier núcleo radiactivo en particular era amplia y continua, un resultado que contrastaba notablemente con los distintos valores de energía observados en la desintegración alfa y gamma. Además, la distribución continua de energía parecía indicar que este proceso de "electrones nucleares" no conservaba la energía. De hecho, en 1929 Bohr propuso modificar la ley de conservación de energía para dar cuenta de la distribución continua de energía. La propuesta obtuvo el apoyo de Werner Heisenberg. Tales consideraciones eran aparentemente razonables, dado que las leyes de la mecánica cuántica habían anulado recientemente las leyes de la mecánica clásica.
Si bien todas estas consideraciones no "probaron" que un electrón no pudiera existir en el núcleo, eran confusas y difíciles de interpretar para los físicos . Se inventaron muchas teorías para explicar cómo los argumentos anteriores podrían estar equivocados. En su monografía de 1931, Gamow resumió todas estas contradicciones, marcando las declaraciones sobre los electrones en el núcleo con símbolos de advertencia.
Descubrimiento del neutrón
En 1930, Walther Bothe y Herbert Becker en Giessen , Alemania, encontraron que si las partículas alfa energéticas emitidas por el polonio caían sobre ciertos elementos ligeros, específicamente el berilio (9
4Ser
), boro (11
5B
), o litio (7
3Li
), se produjo una radiación inusualmente penetrante. El berilio produjo la radiación más intensa. El polonio es altamente radioactivo, produce radiación alfa energética y se usaba comúnmente para experimentos de dispersión en ese momento. La radiación alfa puede verse influenciada por un campo eléctrico, porque está compuesta de partículas cargadas. Sin embargo, la radiación penetrante observada no fue influenciada por un campo eléctrico, por lo que se pensó que era radiación gamma . La radiación fue más penetrante que cualquier rayo gamma conocido, y los detalles de los resultados experimentales fueron difíciles de interpretar.

Dos años más tarde Irène Joliot-Curie y Frédéric Joliot en París demostraron que si esta radiación desconocida caía sobre cera de parafina o cualquier otro compuesto que contenga hidrógeno , expulsaba protones de muy alta energía (5 MeV). Esta observación no era en sí misma incompatible con la supuesta naturaleza de rayos gamma de la nueva radiación, pero esa interpretación ( dispersión de Compton ) tenía un problema lógico. Por consideraciones de energía y momento, un rayo gamma tendría que tener una energía increíblemente alta (50 MeV) para dispersar un protón masivo. En Roma, el joven físico Ettore Majorana declaró que la forma en que la nueva radiación interactuaba con los protones requería una nueva partícula neutra.
Al enterarse de los resultados de París, ni Rutherford ni James Chadwick del Laboratorio Cavendish creyeron en la hipótesis de los rayos gamma. Con la ayuda de Norman Feather , Chadwick rápidamente realizó una serie de experimentos que demostraron que la hipótesis de los rayos gamma era insostenible. El año anterior, Chadwick, JER Constable y EC Pollard ya habían realizado experimentos sobre la desintegración de elementos ligeros utilizando radiación alfa del polonio. También habían desarrollado métodos más precisos y eficientes para detectar, contar y registrar los protones expulsados. Chadwick repitió la creación de la radiación usando berilio para absorber las partículas alfa: 9 Be + 4 He (α) → 12 C + 1 n. Tras el experimento de París, apuntó la radiación a la cera de parafina, un hidrocarburo con alto contenido de hidrógeno, por lo que ofrecía un objetivo denso en protones. Como en el experimento de París, la radiación dispersó energéticamente algunos de los protones. Chadwick midió el rango de estos protones y también midió cómo la nueva radiación impactaba los átomos de varios gases. Descubrió que la nueva radiación no consistía en rayos gamma, sino en partículas sin carga con aproximadamente la misma masa que el protón . Estas partículas eran neutrones. Chadwick ganó el Premio Nobel de Física en 1935 por este descubrimiento.
El año 1932 se denominó más tarde el " annus mirabilis " de la física nuclear en el Laboratorio Cavendish, con los descubrimientos del neutrón, la desintegración nuclear artificial por el acelerador de partículas Cockcroft-Walton y el positrón .
Modelo protón-neutrón del núcleo
Dados los problemas del modelo protón-electrón , se aceptó rápidamente que el núcleo atómico está compuesto de protones y neutrones, aunque inicialmente no estaba clara la naturaleza precisa del neutrón. Meses después del descubrimiento del neutrón, Werner Heisenberg y Dmitri Ivanenko propusieron modelos protón-neutrón para el núcleo. Los artículos emblemáticos de Heisenberg abordaron la descripción de protones y neutrones en el núcleo a través de la mecánica cuántica. Si bien la teoría de Heisenberg para los protones y neutrones en el núcleo fue un "gran paso hacia la comprensión del núcleo como un sistema mecánico cuántico", todavía asumió la presencia de electrones nucleares. En particular, Heisenberg asumió que el neutrón era un compuesto protón-electrón, para el cual no existe una explicación mecánica cuántica. Heisenberg no tenía una explicación de cómo los electrones ligeros podían unirse dentro del núcleo. Heisenberg introdujo la primera teoría de las fuerzas de intercambio nuclear que unen a los nucleones. Consideró que los protones y los neutrones son estados cuánticos diferentes de la misma partícula, es decir, nucleones que se distinguen por el valor de sus números cuánticos de isospín nuclear .
El modelo protón-neutrón explicó el rompecabezas del dinitrógeno. Cuando se propuso que 14 N constara de 3 pares cada uno de protones y neutrones, con un neutrón y un protón no apareados adicionales cada uno contribuyendo con un giro de 1 ⁄ 2 ħ en la misma dirección para un giro total de 1 ħ, el modelo se volvió viable. Pronto, los neutrones se usaron para explicar naturalmente las diferencias de espín en muchos nucleidos diferentes de la misma manera.
Si el modelo protón-neutrón para el núcleo resolvió muchos problemas, destacó el problema de explicar los orígenes de la radiación beta. Ninguna teoría existente podría explicar cómo los electrones, o positrones, podrían emanar del núcleo. En 1934, Enrico Fermi publicó su artículo clásico que describe el proceso de desintegración beta , en el que el neutrón se desintegra en un protón creando un electrón y un neutrino (aún no descubierto) . El artículo empleó la analogía de que los fotones , o radiación electromagnética, se crearon y destruyeron de manera similar en procesos atómicos. Ivanenko había sugerido una analogía similar en 1932. La teoría de Fermi requiere que el neutrón sea una partícula de espín 1 ⁄ 2 . La teoría preservaba el principio de conservación de la energía, que había sido cuestionado por la distribución continua de energía de las partículas beta. La teoría básica de la desintegración beta propuesta por Fermi fue la primera en mostrar cómo se podían crear y destruir partículas. Estableció una teoría básica general para la interacción de partículas por fuerzas débiles o fuertes. Si bien este influyente artículo ha resistido la prueba del tiempo, las ideas que contenía eran tan nuevas que cuando se presentó por primera vez a la revista Nature en 1933 fue rechazado por ser demasiado especulativo.
La naturaleza del neutrón
La cuestión de si el neutrón era una partícula compuesta de un protón y un electrón persistió durante algunos años después de su descubrimiento. En 1932, Harrie Massey exploró un modelo de un neutrón compuesto para explicar su gran poder de penetración a través de la materia y su neutralidad eléctrica, por ejemplo. El problema era un legado de la opinión predominante desde la década de 1920 de que las únicas partículas elementales eran el protón y el electrón.
La naturaleza del neutrón fue un tema principal de discusión en la Séptima Conferencia de Solvay celebrada en octubre de 1933, a la que asistieron Heisenberg, Niels Bohr , Lise Meitner , Ernest Lawrence , Fermi, Chadwick y otros. Como lo planteó Chadwick en su Bakerian Lecture de 1933, la cuestión principal era la masa del neutrón en relación con el protón. Si la masa del neutrón fuera menor que las masas combinadas de un protón y un electrón (1.0078 u ), entonces el neutrón podría ser un compuesto protón-electrón debido al defecto de masa de la energía de enlace nuclear . Si es mayor que las masas combinadas, entonces el neutrón es elemental como el protón. La pregunta fue difícil de responder porque la masa del electrón es solo el 0.05% de la del protón, por lo que se requirieron mediciones excepcionalmente precisas.
La dificultad de realizar la medición queda ilustrada por los valores de amplio rango para la masa del neutrón obtenidos entre 1932 y 1934. El valor aceptado hoy es 1.008 66 u . En el artículo de 1932 de Chadwick que informa sobre el descubrimiento, estimó que la masa del neutrón estaba entre1.005 u y1.008 u . Al bombardear boro con partículas alfa, Frédéric e Irène Joliot-Curie obtuvieron un alto valor de1.012 u , mientras que el equipo de Ernest Lawrence en la Universidad de California midió el pequeño valor1.0006 u utilizando su nuevo ciclotrón .
En 1935, Chadwick y su estudiante de doctorado Maurice Goldhaber resolvieron el problema informando la primera medición precisa de la masa del neutrón. Utilizaron los rayos gamma de 2,6 MeV del talio -208 ( 208 Tl) (entonces conocido como torio C " ) para fotodisintegrar el deuterón.
En esta reacción, el protón y el neutrón resultantes tienen aproximadamente la misma energía cinética, ya que sus masas son aproximadamente iguales. La energía cinética del protón resultante podría medirse (0,24 MeV) y, por lo tanto, podría determinarse la energía de enlace del deuterón (2,6 MeV - 2 (0,24 MeV) = 2,1 MeV, o0,0023 u ). La masa del neutrón podría entonces determinarse mediante el balance de masa simple
m d + ser = m p + m n
donde m d, p, n se refieren al deuterón, protón o masa de neutrones, y "be" es la energía de enlace. Se conocían las masas de deuterón y protón; Chadwick y Goldhaber utilizaron valores de 2,0142 u y 1,0081 u, respectivamente. Descubrieron que la masa del neutrón era ligeramente mayor que la masa del protón.1.0084 u o1,0090 u , dependiendo del valor exacto utilizado para la masa del deuterón. La masa del neutrón era demasiado grande para ser un compuesto protón-electrón, por lo que el neutrón se identificó como una partícula elemental. Chadwick y Goldhaber predijeron que un neutrón libre podría desintegrarse en un protón, un electrón y un neutrino ( desintegración beta ).
Física de neutrones en la década de 1930
Poco después del descubrimiento del neutrón, la evidencia indirecta sugirió que el neutrón tenía un valor inesperado distinto de cero para su momento magnético. Los intentos de medir el momento magnético del neutrón se originaron con el descubrimiento de Otto Stern en 1933 en Hamburgo de que el protón tenía un momento magnético anormalmente grande. En 1934, grupos liderados por Stern, ahora en Pittsburgh , y II Rabi en Nueva York, habían deducido de forma independiente que el momento magnético del neutrón era negativo e inesperadamente grande midiendo los momentos magnéticos del protón y el deuterón . Los valores del momento magnético del neutrón también fueron determinados por Robert Bacher (1933) en Ann Arbor e IY Tamm y SA Altshuler (1934) en la Unión Soviética a partir de estudios de la estructura hiperfina de los espectros atómicos. A fines de la década de 1930, el grupo Rabi había deducido valores precisos para el momento magnético del neutrón utilizando mediciones que empleaban técnicas de resonancia magnética nuclear recientemente desarrolladas . El gran valor del momento magnético del protón y el valor negativo inferido del momento magnético del neutrón fueron inesperados y plantearon muchas preguntas.

El descubrimiento del neutrón proporcionó inmediatamente a los científicos una nueva herramienta para probar las propiedades de los núcleos atómicos. Las partículas alfa se habían utilizado durante las décadas anteriores en experimentos de dispersión, pero tales partículas, que son núcleos de helio, tienen una carga de +2. Esta carga dificulta que las partículas alfa superen la fuerza repulsiva de Coulomb e interactúen directamente con los núcleos de los átomos. Dado que los neutrones no tienen carga eléctrica, no tienen que superar esta fuerza para interactuar con los núcleos. Casi coincidiendo con su descubrimiento, Norman Feather , colega y protegido de Chadwick, utilizó neutrones en experimentos de dispersión con nitrógeno. Feather pudo demostrar que los neutrones que interactúan con los núcleos de nitrógeno se dispersan en protones o inducen al nitrógeno a desintegrarse para formar boro con la emisión de una partícula alfa. Por tanto, Feather fue el primero en demostrar que los neutrones producen desintegraciones nucleares.
En Roma , Enrico Fermi y su equipo bombardearon elementos más pesados con neutrones y descubrieron que los productos eran radiactivos. En 1934 habían utilizado neutrones para inducir radiactividad en 22 elementos diferentes, muchos de ellos de alto número atómico. Al darse cuenta de que otros experimentos con neutrones en su laboratorio parecían funcionar mejor en una mesa de madera que en una mesa de mármol, Fermi sospechó que los protones de la madera estaban ralentizando los neutrones y aumentando así la posibilidad de que el neutrón interactúe con los núcleos. Por lo tanto, Fermi pasó neutrones a través de cera de parafina para frenarlos y descubrió que la radiactividad de algunos elementos bombardeados aumentaba en un factor de decenas a cientos. La sección transversal para la interacción con los núcleos es mucho mayor para los neutrones lentos que para los neutrones rápidos. En 1938, Fermi recibió el Premio Nobel de Física "por sus demostraciones de la existencia de nuevos elementos radiactivos producidos por la irradiación de neutrones, y por su descubrimiento relacionado de las reacciones nucleares provocadas por neutrones lentos" .
En Berlín , la colaboración de Lise Meitner y Otto Hahn , junto con su asistente Fritz Strassmann , impulsó la investigación iniciada por Fermi y su equipo cuando bombardearon uranio con neutrones. Entre 1934 y 1938, Hahn, Meitner y Strassmann encontraron una gran cantidad de productos de transmutación radiactiva de estos experimentos, todos los cuales consideraron transuránicos . Los nucleidos transuránicos son aquellos que tienen un número atómico mayor que el uranio (92), formados por absorción de neutrones; tales nucleidos no ocurren naturalmente. En julio de 1938, Meitner se vio obligada a escapar de la persecución antisemita en la Alemania nazi después del Anschluss , y pudo asegurar un nuevo puesto en Suecia. El experimento decisivo del 16 al 17 de diciembre de 1938 (utilizando un proceso químico llamado " fraccionamiento radio-bario-mesotorio ") produjo resultados desconcertantes: lo que habían entendido que eran tres isótopos de radio se comportaban consistentemente como bario . El radio (número atómico 88) y el bario (número atómico 56) están en el mismo grupo químico . En enero de 1939, Hahn había llegado a la conclusión de que lo que pensaban que eran nucleidos transuránicos eran nucleidos mucho más ligeros, como bario, lantano , cerio y platinoides ligeros . Meitner y su sobrino Otto Frisch interpretaron inmediatamente y correctamente estas observaciones como resultado de la fisión nuclear , un término acuñado por Frisch.
Hahn y sus colaboradores habían detectado la división de núcleos de uranio, inestables por la absorción de neutrones, en elementos más ligeros. Meitner y Frisch también demostraron que la fisión de cada átomo de uranio liberaría alrededor de 200 MeV de energía. El descubrimiento de la fisión electrificó a la comunidad mundial de físicos atómicos y al público. En su segunda publicación sobre fisión nuclear, Hahn y Strassmann predijeron la existencia y liberación de neutrones adicionales durante el proceso de fisión. Frédéric Joliot y su equipo demostraron que este fenómeno era una reacción en cadena en marzo de 1939. En 1945, Hahn recibió el Premio Nobel de Química en 1944 "por su descubrimiento de la fisión de núcleos atómicos pesados".
Después de 1939
El descubrimiento de la fisión nuclear a finales de 1938 marcó un cambio en los centros de investigación nuclear de Europa a Estados Unidos. Un gran número de científicos estaban emigrando a los Estados Unidos para escapar de los problemas y el antisemitismo en Europa y la guerra que se avecinaba (Ver científicos judíos y el Proyecto Manhattan ). Los nuevos centros de investigación nuclear fueron las universidades de los Estados Unidos, en particular la Universidad de Columbia en Nueva York y la Universidad de Chicago, donde Enrico Fermi se había trasladado, y una instalación secreta de investigación en Los Alamos , Nuevo México , establecida en 1942, el nuevo hogar. del proyecto Manhattan . Este proyecto bélico se centró en la construcción de armas nucleares , aprovechando la enorme energía liberada por la fisión del uranio o plutonio a través de reacciones en cadena basadas en neutrones.
Los descubrimientos del neutrón y el positrón en 1932 fueron el comienzo de los descubrimientos de muchas partículas nuevas. Los muones se descubrieron en 1936. Los piones y los kaones se descubrieron en 1947, mientras que las partículas lambda se descubrieron en 1950. A lo largo de las décadas de 1950 y 1960, se descubrió una gran cantidad de partículas llamadas hadrones . Un esquema de clasificación para organizar todas estas partículas, propuesto independientemente por Murray Gell-Mann y George Zweig en 1964, se conoció como el modelo de quarks . Según este modelo, las partículas como el protón y el neutrón no eran elementales, sino que estaban compuestas por varias configuraciones de un pequeño número de otras partículas verdaderamente elementales llamadas partones o quarks . El modelo de quarks recibió verificación experimental a partir de finales de la década de 1960 y finalmente proporcionó una explicación del momento magnético anómalo del neutrón.
Videos
- Ernest Rutherford resume el estado de la física nuclear en 1935. (7 min., Nobelprize.org)
- Hans Bethe analiza el trabajo de Chadwick y Goldhaber sobre la desintegración del deuterón. (2 min., Web de historias)
Notas
Referencias
Otras lecturas
- Bibliografía comentada para neutrones de la Biblioteca digital de Alsos para cuestiones nucleares
- Abraham Pais , Inward Bound , Oxford: Oxford University Press, 1986. ISBN 0198519974 .
- Herwig Schopper , Interacciones débiles y desintegración beta nuclear , Editorial, North-Holland Pub. Co., 1966. OCLC 644015779
- Ruth Lewin Sime , Lise Meitner: A Life in Physics , Berkeley, University of California Press, 1996. ISBN 0520208609 .
- Roger H. Stuewer , "La hipótesis del electrón nuclear". En Otto Hahn y el auge de la física nuclear , William R. Shea, ed. Dordrecht, Holanda: D. Riedel Publishing Company. págs. 19-67, 1983. ISBN 90-277-1584-X .
- Sin-Itiro Tomonaga , The Story of Spin , The University of Chicago Press, 1997. ISBN 9780226807942