Dendrotoxina - Dendrotoxin
Las dendrotoxinas son una clase de neurotoxinas presinápticas producidas por las serpientes mamba ( Dendroaspis ) que bloquean subtipos particulares de canales de potasio activados por voltaje en las neuronas , lo que mejora la liberación de acetilcolina en las uniones neuromusculares . Debido a su alta potencia y selectividad por los canales de potasio, las dendrotoxinas han demostrado ser extremadamente útiles como herramientas farmacológicas para estudiar la estructura y función de estas proteínas de canales iónicos .
Efectos funcionales en el sistema nervioso
Se ha demostrado que las dendrotoxinas bloquean subtipos particulares de canales de potasio (K + ) dependientes de voltaje en el tejido neuronal. En el sistema nervioso, los canales de K + dependientes de voltaje controlan la excitabilidad de los nervios y músculos controlando el potencial de membrana en reposo y repolarizando la membrana durante los potenciales de acción . Se ha demostrado que la dendrotoxina se une a los nodos de Ranvier de las neuronas motoras y bloquea la actividad de estos canales de potasio. De esta manera, las dendrotoxinas prolongan la duración de los potenciales de acción y aumentan la liberación de acetilcolina en la unión neuromuscular, lo que puede resultar en hiperexcitabilidad muscular y síntomas convulsivos.
Estructura de la dendrotoxina
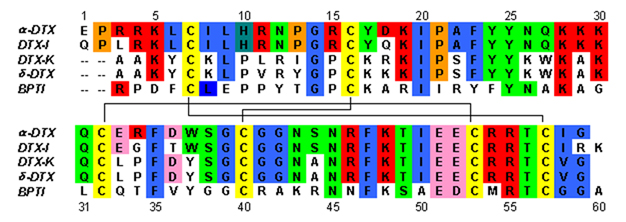
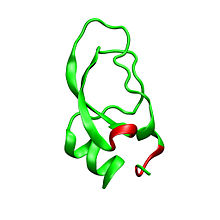
Las dendrotoxinas son proteínas de ~ 7 kDa que constan de una única cadena peptídica de aproximadamente 57-60 aminoácidos . Se han aislado varios homólogos de alfa-dendrotoxina, todos con una secuencia ligeramente diferente. Sin embargo, la arquitectura molecular y la conformación de plegado de estas proteínas son todas muy similares. Las dendrotoxinas poseen una hélice de 3 10 muy corta cerca del extremo N-terminal del péptido, mientras que una hélice alfa de dos vueltas se produce cerca del extremo C-terminal . Una hoja β antiparalela de dos hebras ocupa la parte central de la estructura molecular. Estas dos cadenas β están conectadas por una región de giro β distorsionada que se cree que es importante para la actividad de unión de la proteína. Todas las dendrotoxinas están reticuladas por tres puentes disulfuro , que agregan estabilidad a la proteína y contribuyen en gran medida a su conformación estructural. Los residuos de cisteína que forman estos enlaces disulfuro se han conservado entre todos los miembros de la familia de las dendrotoxinas y se encuentran en C7-C57, C16-C40 y C32-C53 (numerados según la alfa-dendrotoxina).
Las dendrotoxinas son estructuralmente homólogas a los inhibidores de serina proteasa de tipo Kunitz , incluido el inhibidor de tripsina pancreática bovina (BPTI). Se ha demostrado que la alfa-dendrotoxina y el BPTI tienen una identidad de secuencia del 35%, así como enlaces disulfuro idénticos. A pesar de la homología estructural entre estas dos proteínas, las dendrotoxinas no parecen exhibir ninguna actividad proteasa inhibidora medible como BPTI. Esta pérdida de actividad parece resultar de la ausencia de residuos de aminoácidos clave que producen diferencias estructurales que dificultan las interacciones clave necesarias para la actividad de proteasa observada en BPTI.
Las dendrotoxinas son proteínas básicas que poseen una carga neta positiva cuando están presentes en pH neutro . La mayoría de los residuos de aminoácidos cargados positivamente de las dendrotoxinas se encuentran en la parte inferior de la estructura, creando un dominio catiónico en un lado de la proteína. La carga positiva resulta de los residuos de lisina (Lys) y arginina (Arg) que se concentran en tres regiones primarias de la proteína: cerca del extremo N-terminal (Arg3, Arg4, Lys5), cerca del C-terminal (Arg54, Arg55) y en la región estrecha de giro β (Lys28, Lys29, Lys30). Se cree que estos residuos cargados positivamente pueden jugar un papel crítico en la actividad de unión de la dendrotoxina, ya que pueden hacer interacciones potenciales con los sitios aniónicos (aminoácidos cargados negativamente) en el poro de los canales de potasio.
Actividad biológica
Farmacología
Una sola molécula de dendrotoxina se asocia reversiblemente con un canal de potasio para ejercer su efecto inhibidor. Se propone que esta interacción está mediada por interacciones electrostáticas entre los residuos de aminoácidos cargados positivamente en el dominio catiónico de la dendrotoxina y los residuos cargados negativamente en el poro del canal iónico . Se cree que los canales de potasio, similares a otros canales selectivos de cationes, tienen una nube de cargas negativas que preceden a la apertura del poro del canal y que ayudan a conducir los iones de potasio a través de la vía de permeación. Generalmente se cree (aunque no se ha probado) que las moléculas de dendrotoxina se unen a sitios aniónicos cerca de la superficie extracelular del canal y ocluyen físicamente el poro, evitando así la conductancia iónica. Sin embargo, Imredy y MacKinnon han propuesto que la delta-dendrotoxina puede tener un sitio de unión descentrado en sus proteínas diana y puede inhibir el canal al alterar la estructura del canal, en lugar de bloquear físicamente el poro.
Residuos biológicamente importantes
Muchos estudios han intentado identificar qué residuos de aminoácidos son importantes para la actividad de unión de las dendrotoxinas a sus objetivos de canal de potasio. Harvey y col. utilizó modificaciones específicas de residuos para identificar residuos cargados positivamente que eran cruciales para la actividad de bloqueo de la dendrotoxina-I. Informaron que la acetilación de Lys5 cerca de la región N-terminal y Lys29 en la región de giro beta condujo a disminuciones sustanciales en la afinidad de unión de DTX-I. Se han mostrado resultados similares con dendrotoxina-K usando mutagénesis dirigida al sitio para sustituir residuos de lisina y arginina cargados positivamente por alaninas neutras . Estos resultados, junto con muchos otros, han implicado que las lisinas cargadas positivamente en la mitad N-terminal, particularmente Lys5 en la hélice 3 10 , juegan un papel muy importante en la unión de la dendrotoxina a sus objetivos de canal de potasio. Los residuos de lisina en la región de giro β han proporcionado resultados más confusos, que parecen ser biológicamente críticos en algunos homólogos de dendrotoxina y no necesarios para otros. Además, la mutación del triplete de lisina completo (K28-K29-K30) a Ala-Ala-Gly en alfa-DTX dio como resultado un cambio muy pequeño en la actividad biológica.
Existe un acuerdo general de que el residuo de lisina conservado cerca del N-terminal (Lys5 en alfa-DTX) es crucial para la actividad biológica de todas las dendrotoxinas, mientras que residuos adicionales, como los de la región beta-turn, podrían desempeñar un papel. en la especificidad de dendrotoxina al mediar las interacciones de toxinas individuales con sus sitios diana individuales. Esto no solo ayuda a explicar la estricta especificidad de algunas dendrotoxinas para diferentes subtipos de canales de K + activados por voltaje , sino que también explica las diferencias en la potencia de las dendrotoxinas para los canales de K + comunes . Por ejemplo, Wang et al. demostraron que la interacción de dendrotoxina-K con K V 1.1 está mediada por sus residuos de lisina tanto en el extremo N-terminal como en la región de giro β, mientras que la alfa-dendrotoxina parece interactuar con su objetivo únicamente a través del extremo N-terminal. Este dominio interactivo menos expansivo puede ayudar a explicar por qué la alfa-dendrotoxina es menos discriminativa mientras que la dendrotoxina-K es estrictamente selectiva para K V 1.1.
Usos en investigación
Los canales de potasio de las neuronas de los vertebrados muestran un alto grado de diversidad que permite a las neuronas sintonizar con precisión sus propiedades de señalización eléctrica mediante la expresión de diferentes combinaciones de subunidades de los canales de potasio. Además, debido a que regulan el flujo iónico a través de las membranas biológicas, son importantes en muchos aspectos de la regulación celular y la transducción de señales de diferentes tipos de células. Por lo tanto, los canales de potasio activados por voltaje son objetivos para una amplia gama de potentes toxinas biológicas de organismos como serpientes, escorpiones , anémonas de mar y caracoles de cono . Así, la purificación del veneno ha llevado al aislamiento de toxinas peptídicas como las dendrotoxinas, que se han convertido en herramientas farmacológicas útiles para el estudio de los canales de potasio. Debido a su potencia y selectividad por diferentes subtipos de canales de potasio, las dendrotoxinas se han vuelto útiles como sondas moleculares para el estudio estructural y funcional de estas proteínas. Esto puede ayudar a mejorar nuestra comprensión de las funciones que desempeñan los tipos de canales individuales, así como ayudar en la clasificación farmacológica de estos diversos tipos de canales. Además, la disponibilidad de dendrotoxinas radiomarcadas proporciona una herramienta para el cribado de otras fuentes en la búsqueda de nuevas toxinas de los canales de potasio, como la clase de calicludina de las toxinas de los canales de potasio en las anémonas de mar. Por último, la información estructural proporcionada por las dendrotoxinas puede proporcionar pistas para la síntesis de compuestos terapéuticos que pueden dirigirse a clases particulares de canales de potasio. La dendrotoxina I también se ha utilizado para ayudar a purificar y caracterizar la proteína del canal de K + a la que se une mediante diferentes ensayos de unión y técnicas de cromatografía.
Referencias
- ^ Gasparini S, Danse JM, Licoq A, Pinkasfeld S, Zinn-Justin S, Young LC, CL de Medeiros C, Rowan EG, Harvey AL y Me'nez A (1998). Delimitación del sitio funcional de la alfa-dendrotoxina: Las topografías funcionales de las dendrotoxinas son diferentes pero comparten un núcleo conservado con las de otrastoxinas bloqueadoras de los canales de potasioK V 1. Revista de química biológica 273: 25393-25403
- ↑ Katoh E, Nishio H, Inui T, Nishiuchi Y, Kimura T, Sakakibara S, Yamazaki T (2000). Base estructural de la actividad biológica de la dendrotoxina-I, un potente bloqueador de los canales de potasio. Biopolímeros 54: 44-57
- ^ Swaminathan P, Hariharan M, Murali R, Singh CU (1996). Estructura molecular, análisis conformacional y estudios de estructura-actividad de la dendrotoxina y sus homólogos utilizando técnicas de mecánica molecular y dinámica molecular. Revista de Química Medicinal . 39: 2141-2155
- ^ Imredy JP y MacKinnon R (2000). Interacciones energéticas y estructurales entre delta-dendrotoxina y un canal de potasio dependiente de voltaje. Revista de Biología Molecular 296: 1283-1294
- ^ Harvey AL, Rowan EG, Vatanpour H, Engstrom A, Westerlund B, Karlsson E (1997). Cambios en la actividad biológica tras la acetilación de dendrotoxina I de Dendroaspis polylepis (mamba negra). ' 35: 1263-1273
- ^ Wang FC, Bell N, Reid P, Smith LA, McIntosh P, Robertson B y Dolly JO (1999). Identificación de residuos en la dendrotoxina K responsables de su discriminación entrecanalesneuronales de K + que contienensubunidades alfa deK V 1.1 y 1.2. Revista europea de bioquímica 263: 222-229
- ^ Yoshida S y Matsumoto S (2005). Efectos de la alfa-dendrotoxina sobre lascorrientes deK + y los potenciales de acción en las neuronas del ganglio del trigémino de ratas adultas resistentes a la tetrodotoxina. Revista de farmacología y terapéutica experimental 314: 437-445
- ^ Rehm, H .; Lazdunski, M. (1 de julio de 1988). "Purificación y estructura de subunidades de una supuesta proteína del canal de K + identificada por sus propiedades de unión a la dendrotoxina I." Actas de la Academia Nacional de Ciencias . 85 (13): 4919–4923. Código bibliográfico : 1988PNAS ... 85.4919R . doi : 10.1073 / pnas.85.13.4919 . ISSN 0027-8424 . PMC 80549 . PMID 2455300 .
enlaces externos
- dendrotoxina en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .