Celda Daniell - Daniell cell
La celda Daniell es un tipo de celda electroquímica inventada en 1836 por John Frederic Daniell , un químico y meteorólogo británico , y consiste en una olla de cobre llena de una solución de sulfato de cobre (II) , en la que se sumerge un recipiente de barro sin esmaltar lleno de sulfúrico. ácido y un electrodo de zinc. Estaba buscando una manera de eliminar el problema de las burbujas de hidrógeno que se encuentran en la pila voltaica , y su solución fue usar un segundo electrolito para consumir el hidrógeno producido por el primero. El ácido sulfúrico se puede sustituir por sulfato de zinc . La celda Daniell supuso una gran mejora con respecto a la tecnología existente utilizada en los primeros días del desarrollo de la batería . Una variante posterior de la celda de Daniell llamada celda de gravedad o celda de pata de gallo fue inventada en la década de 1860 por un francés llamado Callaud y se convirtió en una opción popular para la telegrafía eléctrica .
La celda de Daniell es también la base histórica para la definición contemporánea del voltio , que es la unidad de fuerza electromotriz en el Sistema Internacional de Unidades . Las definiciones de unidades eléctricas que se propusieron en la Conferencia Internacional de Electricistas de 1881 se diseñaron de modo que la fuerza electromotriz de la celda Daniell fuera de aproximadamente 1,0 voltios. Con las definiciones contemporáneas, el potencial estándar de la celda Daniell a 25 ° C es en realidad 1,10 V.
Química
En la celda Daniell, los electrodos de cobre y zinc se sumergen en una solución de sulfato de cobre (II) y sulfato de zinc , respectivamente. En el ánodo (electrodo negativo), el zinc se oxida según la siguiente media reacción:
- Zn (s) → Zn 2+ (aq) + 2e - . . ( Potencial de reducción de electrodo estándar −0,7618 V)
En el cátodo (electrodo positivo), el cobre se reduce según la siguiente reacción:
- Cu 2+ (aq) + 2e - → Cu (s) . . ( Potencial de reducción de electrodo estándar +0,340 V)
Tenga en cuenta que los iones de cobre cargados positivamente se mueven hacia el electrodo positivo, impulsados por una reducción de la energía química.
La reacción total es:
- Zn (s) + Cu 2+ (aq) → Zn 2+ (aq) + Cu (s). . ( Voltaje de circuito abierto 1.1018 V)
Estos procesos dan como resultado la acumulación de cobre sólido en el cátodo y la corrosión del electrodo de zinc en la solución como cationes de zinc. La celda de Daniell produce aproximadamente 213 kJ por mol (65 g) de zinc. Esta energía se puede atribuir principalmente a la unión más débil de 207 kJ / mol (menor magnitud de la energía cohesiva) en el zinc en comparación con el cobre metálico, lo que se puede explicar en términos de la falta de unión a través de orbitales d parcialmente llenos en zinc.
En las demostraciones en el aula, a menudo se usa una forma de celda Daniell conocida como dos medias celdas debido a su simplicidad. Cada una de las dos mitades de células soporta la mitad de las reacciones descritas anteriormente. Un cable y una bombilla pueden conectar los dos electrodos. Los electrones en exceso producidos por la oxidación del zinc metálico son "empujados" fuera del ánodo, que es por lo tanto el electrodo negativo, viajan a través del alambre y son "empujados" hacia el cátodo de cobre donde son consumidos por la reducción de iones de cobre. Esto proporciona una corriente eléctrica que ilumina la bombilla.
Dado que ninguna de las medias reacciones se producirá independientemente de la otra, las dos medias celdas deben estar conectadas de manera que permitan que los iones se muevan libremente entre ellas. Se puede usar una barrera porosa o un disco cerámico para separar las dos soluciones mientras se permite el flujo de iones sulfato. Cuando las medias celdas se colocan en dos contenedores completamente diferentes y separados, a menudo se usa un puente de sal para conectar las dos celdas. El puente de sal normalmente contiene una alta concentración de nitrato de potasio (una sal que no interferirá químicamente con la reacción en ninguna de las medias celdas). En la celda húmeda anterior durante la descarga, los aniones nitrato en el puente de sal se mueven hacia la media celda de zinc para equilibrar el aumento de iones Zn 2+ . Al mismo tiempo, los iones de potasio del puente de sal se mueven hacia la media celda de cobre para reemplazar los iones de Cu 2+ que se precipitan en el electrodo de cobre.
Si la celda está conectada a una fuente potencial (por ejemplo, un cargador de batería) de manera que la diferencia de potencial de la fuente es ligeramente mayor que la fem de la celda (1.1 v), entonces el flujo de corriente podría invertirse y la reacción se convertiría en:
Por lo tanto, la celda Daniell es reversible, si la corriente extraída (o alimentada) de ella es pequeña. La celda Daniell se puede utilizar para "generar" electricidad, consumiendo un electrodo, o para almacenar electricidad.
Desarrollo
Construcción original de Daniell
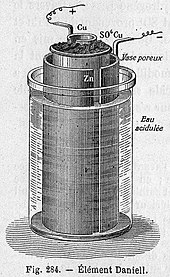
Daniell construyó su celda por primera vez en 1836. Su diseño original consistía en un cilindro de cobre de 3,5 pulgadas de diámetro. Se colocó un disco de cobre perforado con numerosos agujeros a través del cilindro empotrado hacia abajo desde la parte superior. Un tubo de garganta de buey colgaba de un gran agujero en el centro del disco de cobre perforado. Una varilla de zinc de 0,5 pulgadas de diámetro colgaba dentro de este tubo de garganta de buey suspendido de soportes de madera. El recipiente de cobre se llenó con una solución de ácido sulfúrico saturada con sulfato de cobre por encima del nivel del disco perforado. El tubo de garganta de buey se llenó con una solución de ácido sulfúrico. Se apilaron cristales de sulfato de cobre sobre el disco de cobre perforado para mantener la solución saturada. La garganta de buey actúa como una membrana porosa que permite el paso de iones. Daniell afirma que se puede usar un tubo de barro poroso en lugar de la garganta de buey para una mayor facilidad práctica, pero esta disposición producirá menos energía. Otra sugerencia hecha por Daniell para mejorar la celda fue reemplazar el cobre con platino y el sulfato de cobre con cloruro de platino , pero comenta que "tal arreglo sería perfecto, pero demasiado costoso para aplicaciones ordinarias". Es la forma de olla porosa de la célula que llegó a ser ampliamente utilizada en telegrafía.
Célula de maceta porosa
La celda de olla porosa consiste en un ánodo de zinc central sumergido en una olla de barro poroso que contiene una solución de sulfato de zinc. La olla porosa, a su vez, se sumerge en una solución de sulfato de cobre contenida en una lata de cobre, que actúa como cátodo de la célula. El uso de una barrera porosa permite que los iones pasen pero evita que las soluciones se mezclen. Sin esta barrera, cuando se extrae ninguna corriente los iones de cobre a la deriva con el ánodo de cinc y someterse a reducción sin producir una corriente, que acortará la vida de la batería. La sustitución del ácido sulfúrico por sulfato de zinc fue la innovación de JF Fuller en 1853. Prolonga la vida útil de la celda.
Con el tiempo, la acumulación de cobre bloqueará los poros de la barrera de loza y acortará la vida útil de la batería. Sin embargo, la celda Daniell proporciona una corriente más larga y confiable que la pila Voltaic porque el electrolito depositó cobre, que es un conductor , en lugar de hidrógeno, que es un aislante , en el cátodo. También es más seguro y menos corrosivo. Con un voltaje de funcionamiento de aproximadamente 1,1 voltios, vio un uso generalizado en las redes de telégrafos hasta que fue reemplazado por la celda de Leclanché a fines de la década de 1860.
Celda de gravedad
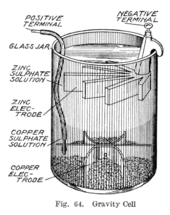
En algún momento durante la década de 1860, un francés de nombre Callaud inventó una variante de la celda Daniell que prescindía de la barrera porosa. En cambio, una capa de sulfato de zinc se asienta sobre una capa de sulfato de cobre, los dos líquidos se mantienen separados por sus diferentes densidades, a menudo con una capa de aceite agregada en la parte superior para evitar la evaporación. Esto reduce la resistencia interna del sistema y, por lo tanto, la batería produce una corriente más fuerte.
Esta variante, llamada celda de gravedad, consiste en un frasco de vidrio en el que un cátodo de cobre se asienta en el fondo y un ánodo de zinc está suspendido debajo del borde en la capa de sulfato de zinc. Los cristales de sulfato de cobre se esparcen alrededor del cátodo y luego el frasco se llena con agua destilada. A medida que se extrae la corriente, se forma una capa de solución de sulfato de zinc en la parte superior alrededor del ánodo. Esta capa superior se mantiene separada de la capa inferior de sulfato de cobre por su menor densidad y por la polaridad de la celda. Una desventaja de la celda de gravedad es que debe extraerse una corriente continuamente para evitar que las dos soluciones se mezclen por difusión, por lo que no es adecuada para un uso intermitente. Además, era vulnerable a la pérdida de integridad si se extraía demasiada corriente eléctrica , lo que también hace que las capas se mezclen.
A veces llamada celda de pata de gallo debido a la forma distintiva de los electrodos, esta disposición es menos costosa para las baterías multicelda grandes y rápidamente se convirtió en la batería preferida para las redes de telégrafos estadounidenses y británicas. Incluso después de que la mayoría de las líneas telegráficas comenzaron a funcionar con motores-generadores, la batería de gravedad continuó utilizándose en estaciones de paso para alimentar el circuito local al menos hasta la década de 1950. En la industria del telégrafo, esta batería a menudo era ensamblada en el sitio por los propios trabajadores del telégrafo, y cuando se agotaba, se podía renovar reemplazando los componentes consumidos. La capa de sulfato de zinc es transparente en contraste con la capa de sulfato de cobre azul profundo, lo que permite al técnico determinar la duración de la batería de un vistazo. Por otro lado, esta configuración significa que la batería solo se puede usar en un aparato estacionario, de lo contrario, las soluciones se mezclarían o se derramarían.
Uso en electrometalurgia
Celda de pájaro
Una variante de la celda Daniell fue inventada en 1837 por el médico del hospital Guy Golding Bird, quien utilizó una barrera de yeso de París para mantener las soluciones separadas. Los experimentos de Bird con esta célula fueron de cierta importancia para la nueva disciplina de la electrometalurgia , pero el propio Bird no se dedicó a este campo; su interés estaba en la electroterapia . Un resultado sorprendente de los experimentos de Bird fue la deposición de cobre sobre el yeso poroso y en las venas que lo atraviesan sin ningún contacto con los electrodos metálicos. Tan sorprendente, de hecho, que al principio los investigadores electroquímicos, incluido Michael Faraday , no lo creyeron . El propio Bird tuvo que examinar cuidadosamente su aparato en busca de contacto inadvertido, tal vez a través del crecimiento de "bigotes" de cobre, antes de estar convencido del resultado. La deposición de cobre y otros metales se había observado anteriormente, pero siempre anteriormente había sido metal sobre electrodo de metal.
Electrotipado
John Dancer , un fabricante de instrumentos de Liverpool, fue en 1838 el primero en aprovechar comercialmente las características únicas de la celda Daniell para el enchapado de cobre. En un proceso ahora conocido como electrotipado , descubrió que podía hacer objetos con cualquier forma deseada utilizando la barrera porosa como molde. Sin embargo, muchos otros habían hecho el mismo descubrimiento y en una disputa de patente con Thomas Spencer se señaló que Bird tenía prioridad para el principio. El crédito por la invención de la electrotipado se suele atribuir al ruso Moritz von Jacobi .
Ver también
Referencias
Otras lecturas
- Saslow, Wayne M. (1999), "Células voltaicas para físicos: dos bombas de superficie y una resistencia interna", American Journal of Physics , 67 (7): 574–583, Bibcode : 1999AmJPh..67..574S , doi : 10.1119 / 1.19327
- Lester, James C .; Vicari, Rosa María; Paraguaçu, Fábio (2004), Lester, James C .; Vicari, Rosa María; Paraguaçu, Fábio (eds.), A Qualitative Model of Daniell Cell for Chemical Education , Lecture Notes in Computer Science, 3220 , doi : 10.1007 / b100137 , hdl : 10092/340 , ISBN 978-3-540-22948-3