Ciclopentadieno - Cyclopentadiene
|
|
|||

|
|||
| Nombres | |||
|---|---|---|---|
|
Nombre IUPAC preferido
Ciclopenta-1,3-dieno |
|||
| Otros nombres
1,3-ciclopentadieno
piropentileno |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| Abreviaturas | CPD, HCp | ||
| 471171 | |||
| CHEBI | |||
| ChemSpider | |||
| Tarjeta de información ECHA |
100.008.033 |
||
| Número CE | |||
| 1311 | |||
| Malla | 1,3-ciclopentadieno | ||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
|
Tablero CompTox ( EPA )
|
|||
|
|||
|
|||
| Propiedades | |||
| C 5 H 6 | |||
| Masa molar | 66,103 g · mol −1 | ||
| Apariencia | Líquido incoloro | ||
| Olor | irritante, similar al terpeno | ||
| Densidad | 0,786 g cm −3 | ||
| Punto de fusion | -90 ° C; −130 ° F; 183 K | ||
| Punto de ebullición | 39 a 43 ° C; 102 a 109 ° F; 312 hasta 316 K | ||
| insoluble | |||
| Presión de vapor | 400 mmHg (53 kPa) | ||
| Acidez (p K a ) | dieciséis | ||
| Base conjugada | Anión ciclopentadienilo | ||
| −44,5 × 10 −6 cm 3 mol −1 | |||
| Estructura | |||
| Planar | |||
| Termoquímica | |||
|
Capacidad calorífica ( C )
|
115,3 JK −1 mol −1 | ||
|
Entropía molar estándar ( S |
182,7 JK −1 mol −1 | ||
| Riesgos | |||
| punto de inflamabilidad | 25 ° C (77 ° F; 298 K) | ||
| Dosis o concentración letal (LD, LC): | |||
|
LC 50 ( concentración media )
|
14.182 ppm (rata, 2 h) 5091 ppm (ratón, 2 h) |
||
| NIOSH (límites de exposición a la salud de EE. UU.): | |||
|
PEL (permitido)
|
TWA 75 ppm (200 mg / m 3 ) | ||
|
REL (recomendado)
|
TWA 75 ppm (200 mg / m 3 ) | ||
|
IDLH (peligro inmediato)
|
750 ppm | ||
| Compuestos relacionados | |||
|
Hidrocarburos relacionados
|
Benceno ciclobutadieno ciclopenteno |
||
|
Compuestos relacionados
|
Diciclopentadieno | ||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencias de Infobox | |||
El ciclopentadieno es un compuesto orgánico con la fórmula C 5 H 6 . A menudo se abrevia CpH porque el anión ciclopentadienilo se abrevia Cp - .
Este líquido incoloro tiene un olor fuerte y desagradable . A temperatura ambiente, este dieno cíclico se dimeriza en el transcurso de horas para dar diciclopentadieno mediante una reacción de Diels-Alder . Este dímero se puede restaurar calentando para dar el monómero.
El compuesto se utiliza principalmente para la producción de ciclopenteno y sus derivados. Se utiliza popularmente como precursor del anión ciclopentadienilo (Cp - ), un ligando importante en los complejos de ciclopentadienilo en la química organometálica .
Producción y reacciones
La producción de ciclopentadieno generalmente no se distingue de la de diciclopentadieno ya que se interconvierten. Se obtienen a partir de alquitrán de hulla (alrededor de 10 a 20 g / tonelada) y mediante craqueo al vapor de nafta (alrededor de 14 kg / tonelada). Para obtener el monómero de ciclopentadieno, el diciclopentadieno comercial se rompe calentando a aproximadamente 180 ° C. El monómero se recoge por destilación y se utiliza poco después. Es aconsejable utilizar algún tipo de columna de fraccionamiento al hacer esto, para eliminar el dímero no agrietado que refluye.
Reordenamiento sigmatrópico
Los átomos de hidrógeno en ciclopentadieno experimentan rápidos [1,5] turnos -sigmatropic como se indica por 1 H espectros de RMN registrado a diversas temperaturas. Aún más fluxionales son los derivados C 5 H 5 E (CH 3 ) 3 (E = Si , Ge , Sn ), en los que el elemento más pesado migra de carbono a carbono con una barrera de activación baja.
Reacciones de Diels-Alder
El ciclopentadieno es un dieno altamente reactivo en la reacción de Diels-Alder porque se requiere una distorsión mínima del dieno para lograr la geometría envolvente del estado de transición en comparación con otros dienos. Es conocido que el ciclopentadieno se dimeriza. La conversión se produce en horas a temperatura ambiente, pero el monómero se puede almacenar durante días a -20 ° C.
Desprotonación
El compuesto es inusualmente ácido (p K a = 16) para un hidrocarburo , un hecho que se explica por la alta estabilidad del anión ciclopentadienilo aromático , C
5H-
5. La desprotonación se puede lograr con una variedad de bases, típicamente hidruro de sodio, sodio metálico y butil litio . Las sales de este anión están disponibles comercialmente, incluyendo ciclopentadienuro de sodio y ciclopentadienuro de litio . Se utilizan para preparar complejos de ciclopentadienilo .
Derivados de metaloceno
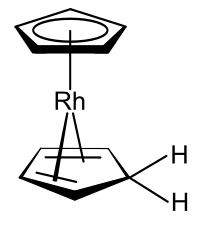
Los metalocenos y los derivados de ciclopentadienilo relacionados se han investigado intensamente y representan una piedra angular de la química organometálica debido a su alta estabilidad. El primer metaloceno caracterizado, el ferroceno , se preparó de la misma manera que se preparan muchos otros metalocenos: combinando derivados de metales alcalinos de la forma MC 5 H 5 con dihaluros de los metales de transición : como ejemplo típico, el níquelceno se forma al tratar cloruro de níquel (II) con ciclopentadienida de sodio en THF .
- NiCl 2 + 2 NaC 5 H 5 → Ni (C 5 H 5 ) 2 + 2 NaCl
Se conocen complejos organometálicos que incluyen tanto el anión ciclopentadienilo como el propio ciclopentadieno, un ejemplo de los cuales es el derivado de rodoceno producido a partir del monómero de rodoceno en disolventes próticos .
Síntesis orgánica
Fue el material de partida en la síntesis de dodecaedrano de Leo Paquette de 1982 . El primer paso implicó la dimerización reductora de la molécula para dar dihidrofulvaleno , no una simple adición para dar diciclopentadieno.
Usos
Además de servir como precursor de los catalizadores basados en ciclopentadienilo, la principal aplicación comercial del ciclopentadieno es como precursor de los comonómeros . La semihidrogenación da ciclopenteno . La reacción de Diels-Alder con butadieno da etiliden norborneno , un comonómero en la producción de cauchos EPDM .
Derivados

El ciclopentadieno puede sustituir uno o más hidrógenos, formando derivados que tienen enlaces covalentes:
- Ciclopentadienos voluminosos
- Calicene
- Ciclopentadienona
- Di- terc- butilciclopentadieno
- Metilciclopentadieno
- Pentametilciclopentadieno
- Pentacianociclopentadieno
La mayoría de estos ciclopentadienos sustituidos también pueden formar aniones y unirse a complejos de ciclopentadienilo .