Detección de coincidencias en neurobiología - Coincidence detection in neurobiology
La detección de coincidencias en el contexto de la neurobiología es un proceso mediante el cual una neurona o un circuito neural puede codificar información detectando la aparición de señales de entrada temporalmente cercanas pero distribuidas espacialmente. Los detectores de coincidencia influyen en el procesamiento de la información neuronal reduciendo la fluctuación temporal , reduciendo la actividad espontánea y formando asociaciones entre eventos neuronales separados. Este concepto ha llevado a una mayor comprensión de los procesos neuronales y la formación de mapas computacionales en el cerebro.
Principios de detección de coincidencias
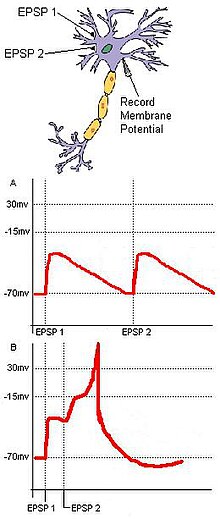
La detección de coincidencias se basa en entradas separadas que convergen en un objetivo común. Considere un circuito neuronal básico con dos neuronas de entrada, A y B, que tienen terminales sinápticas excitadoras que convergen en una sola neurona de salida, C (figura 1). Si el EPSP de cada neurona de entrada está por debajo del umbral de un potencial de acción en C, entonces C no se disparará a menos que las dos entradas de A y B estén juntas temporalmente. La llegada sincrónica de estas dos entradas puede empujar el potencial de membrana de una neurona objetivo por encima del umbral requerido para crear un potencial de acción. Si las dos entradas llegan demasiado separadas, la despolarización de la primera entrada puede tener tiempo de disminuir significativamente, evitando que el potencial de membrana de la neurona objetivo alcance el umbral del potencial de acción. Este ejemplo incorpora los principios de la suma espacial y temporal . Además, la detección de coincidencias puede reducir la fluctuación formada por la actividad espontánea. Si bien es posible que los estímulos subumbrales aleatorios por parte de las células neuronales no se activen con frecuencia de manera coincidente, las entradas sinápticas coincidentes derivadas de un estímulo externo unitario asegurarán que una neurona objetivo se active como resultado del estímulo.
Detección de coincidencia distal
La descripción anterior se aplica bien a las entradas de retroalimentación a las neuronas, que proporcionan entradas de los nervios sensoriales o de regiones de nivel inferior en el cerebro. Aproximadamente el 90% de las conexiones interneurales no son, sin embargo, de naturaleza anticipada sino predictiva (o moduladora o atencional). Estas conexiones reciben entradas principalmente de células cercanas en la misma capa que la célula receptora, y también de conexiones distantes que se alimentan a través de la Capa 1. Las dendritas que reciben estas entradas están bastante distantes del cuerpo celular y, por lo tanto, exhiben diferentes características eléctricas y eléctricas. Comportamiento de procesamiento de señales en comparación con las dendritas proximales (o feedforward) descritas anteriormente.
En una sección corta (quizás 40 µm de largo) de dendrita distal, la reacción a las activaciones que entran en las sinapsis de las espinas dendríticas actúa para aumentar el potencial local general con cada señal entrante. Este potencial creciente actúa en un contexto de deterioro en el potencial de regreso al nivel de reposo. Si se reciben suficientes señales en un corto período de tiempo (es decir, antes de que el voltaje general decaiga a fondo), el voltaje del segmento se elevará por encima de un umbral, dando lugar a un pico dendrítico no lineal, que viaja, efectivamente, sin disminuir, todo el camino hacia el cuerpo celular, y lo que hace que se despolarice parcialmente.
Esta es quizás la forma más importante de detección de coincidencias dendríticas en el cerebro. La activación proximal más fácil de entender actúa durante períodos de tiempo mucho más largos y, por tanto, es mucho menos sensible al factor tiempo en la detección de coincidencias.
Localización de sonido
Se ha demostrado que la detección de coincidencias es un factor importante en la localización del sonido a lo largo del plano azimutal en varios organismos. En 1948, Lloyd A. Jeffress propuso que algunos organismos pueden tener una colección de neuronas que reciben información auditiva de cada oído. Las vías neurales que conducen a estas neuronas se denominan líneas de retardo. Jeffress afirmó que las neuronas que enlazan las líneas de retardo actúan como detectores de coincidencia disparando al máximo cuando reciben entradas simultáneas de ambos oídos. Cuando se escucha un sonido, las ondas sonoras pueden llegar a los oídos en diferentes momentos. Esto se conoce como diferencia de tiempo interaural (DTI). Debido a las diferentes longitudes y una velocidad de conducción finita dentro de los axones de las líneas de retardo, se dispararán diferentes neuronas detectoras de coincidencia cuando el sonido provenga de diferentes posiciones a lo largo del acimut. El modelo de Jeffress propone que dos señales, incluso de una llegada asincrónica de sonido en la cóclea de cada oído, convergerán sincrónicamente en un detector de coincidencia en la corteza auditiva en función de la magnitud de la ITD (Fig. 2). Por lo tanto, el ITD debe corresponder a un mapa anatómico que se puede encontrar dentro del cerebro. El estudio de Masakazu Konishi sobre las lechuzas comunes muestra que esto es cierto. La información sensorial de las células ciliadas de los oídos viaja al núcleo magnocelular ipsilateral. Desde aquí, las señales se proyectan ipsilateral y contralateralmente a dos núcleos laminari. Cada núcleo laminaris contiene detectores de coincidencia que reciben información auditiva del oído izquierdo y derecho. Dado que los axones ipsolaterales entran en el núcleo laminar dorsalmente mientras que los axones contralaterales entran en la zona ventral, los sonidos de varias posiciones a lo largo del acimut corresponden directamente a la estimulación de diferentes profundidades del núcleo laminar. A partir de esta información, se formó un mapa neuronal del espacio auditivo. La función del núcleo laminaris es paralela a la del olivo superior medial en los mamíferos.
Plasticidad y asociatividad sináptica
En 1949, Donald Hebb postuló que la eficiencia sináptica aumentará mediante la estimulación repetida y persistente de una célula postsináptica por una célula presináptica. Esto a menudo se resume informalmente como " células que disparan juntas, se conectan juntas ". La teoría fue validada en parte por el descubrimiento de la potenciación a largo plazo . Los estudios de LTP en múltiples células presinápticas que estimulan una célula postsináptica descubrieron la propiedad de la asociatividad. Una estimulación neuronal débil sobre una neurona piramidal puede no inducir una potenciación a largo plazo. Sin embargo, esta misma estimulación combinada con una fuerte estimulación simultánea de otra neurona fortalecerá ambas sinapsis . Este proceso sugiere que dos vías neuronales que convergen en la misma célula pueden fortalecerse si se estimulan de manera coincidente.
Mecanismo molecular de potenciación a largo plazo.
La LTP en el hipocampo requiere una despolarización prolongada que puede expulsar el bloqueo Mg 2+ de los receptores NMDA postsinápticos . La eliminación del bloque de Mg 2+ permite el flujo de Ca 2+ hacia la celda. Una gran elevación de los niveles de calcio activa las proteínas quinasas que, en última instancia, aumentan el número de receptores AMPA postsinápticos . Esto aumenta la sensibilidad de la célula postsináptica al glutamato . Como resultado, ambas sinapsis se fortalecen. La despolarización prolongada necesaria para la expulsión de Mg 2+ de los receptores NMDA requiere una estimulación de alta frecuencia. La asociatividad se convierte en un factor porque esto se puede lograr a través de dos entradas simultáneas que pueden no ser lo suficientemente fuertes para activar LTP por sí mismas.
Además de los procesos basados en el receptor de NMDA, otros mecanismos celulares permiten la asociación entre dos señales de entrada diferentes que convergen en la misma neurona, en un período de tiempo definido. Ante un aumento simultáneo de las concentraciones intracelulares de AMPc y Ca 2+ , se activa un coactivador transcripcional llamado TORC1 ( CRTC1 ), que convierte la coincidencia temporal de los dos segundos mensajeros en cambios a largo plazo como LTP. Este mecanismo celular, a través de la activación de la adenilato ciclasa dependiente de calcio , también podría explicar la detección de la estimulación repetitiva de una sinapsis determinada .
La adenilil ciclasa (también conocida comúnmente como adenil ciclasa y adenilato ciclasa ) se ha implicado en la formación de la memoria como detector de coincidencias.
Mecanismo molecular de la depresión a largo plazo.
La depresión a largo plazo también funciona a través de propiedades asociativas, aunque no siempre es el proceso inverso de la LTP. LTD en el cerebelo requiere una estimulación coincidente de fibras paralelas y fibras trepadoras . El glutamato liberado de las fibras paralelas activa los receptores AMPA que despolarizan la célula postsináptica. Las fibras paralelas también activan los receptores metabotrópicos de glutamato que liberan los segundos mensajeros IP 3 y DAG. Las fibras trepadoras estimulan un gran aumento en los niveles postsinápticos de Ca 2+ cuando se activan. El Ca 2+ , IP 3 y DAG trabajan juntos en una vía de transducción de señales para internalizar los receptores AMPA y disminuir la sensibilidad de la célula postsináptica al glutamato.
Ver también
Referencias
Otras lecturas
- Bender, VA; Bender, KJ; Brasier, DJ; Feldman, DE (2006). "Dos detectores de coincidencia para plasticidad dependiente del tiempo de pico en la corteza somatosensorial" . Revista de neurociencia . 26 (16): 4166–4177. doi : 10.1523 / JNEUROSCI.0176-06.2006 . PMC 3071735 . PMID 16624937 .
- Caillard, O .; Ben-Ari, Y .; Gaiarsa, JL (1999). "Potenciación a largo plazo de la transmisión sináptica GABAérgica en hipocampo de rata neonatal" . La revista de fisiología . 518 (Parte 1): 109-119. doi : 10.1111 / j.1469-7793.1999.0109r.x . PMC 2269393 . PMID 10373693 .
- Joris, PX; Smith, PH; Yin, TC (1998). "Detección de coincidencias en el sistema auditivo: 50 años después de Jeffress" . Neurona . 21 (6): 1235-1238. doi : 10.1016 / S0896-6273 (00) 80643-1 . PMID 9883717 .
- https://web.archive.org/web/20040519194818/http://bbsonline.cup.cam.ac.uk/Preprints/OldArchive/bbs.neur4.crepel.html
enlaces externos
- Localización auditiva por análisis ITD: El modelo de Jeffress - Tutorial interactivo en línea (Flash)