Cobaltoceno - Cobaltocene
|
|
|||
| Nombres | |||
|---|---|---|---|
|
Nombres IUPAC
Cobaltoceno
Bis ( η 5- ciclopentadienil) cobalto |
|||
| Otros nombres
Cp 2 Co
|
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| CHEBI | |||
| ChemSpider | |||
| Tarjeta de información ECHA | 100.013.692 | ||
| Número CE | |||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
|
Tablero CompTox ( EPA )
|
|||
|
|||
|
|||
| Propiedades | |||
| [Co ( η 5 -C 5 H 5 ) 2 ] | |||
| Masa molar | 189,12 g / mol | ||
| Apariencia | Sólido violeta oscuro | ||
| Punto de fusion | 171–173 ° C (340–343 ° F; 444–446 K) | ||
| Insoluble | |||
| Estructura | |||
| emparedado | |||
| cero | |||
| Termoquímica | |||
|
Entropía molar estándar ( S |
236 JK −1 mol −1 | ||
| +237 kJ / mol (incierto) | |||
| −5839 kJ / mol | |||
| Peligros | |||
| Ficha de datos de seguridad | SDS externo | ||
| Pictogramas GHS |
 
|
||
| Palabra de señal GHS | Peligro | ||
| H228 , H317 , H351 | |||
| P210 , P261 , P280 , P363 , P405 , P501 | |||
| NFPA 704 (diamante de fuego) | |||
| Compuestos relacionados | |||
|
Metalocenos relacionados
|
Ferroceno Niloceno Rodoceno |
||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencias de Infobox | |||
El cobaltoceno , también conocido como bis (ciclopentadienil) cobalto (II) o incluso "bis Cp cobalto", es un compuesto de organocobalto con la fórmula Co (C 5 H 5 ) 2 . Es un sólido de color púrpura oscuro que se sublima fácilmente ligeramente por encima de la temperatura ambiente. El cobaltoceno se descubrió poco después del ferroceno , el primer metaloceno . Debido a la facilidad con la que reacciona con el oxígeno, el compuesto debe manipularse y almacenarse utilizando técnicas sin aire .
Síntesis
El cobaltoceno se prepara mediante la reacción de ciclopentadienuro de sodio (NaC 5 H 5 ) con cloruro de cobalto (II) anhidro en una solución de THF . El cloruro de sodio se cogenera y el producto organometálico generalmente se purifica por sublimación al vacío .
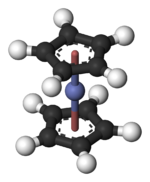
Estructura y vinculación
En Co (C 5 H 5 ) 2, el centro de Co está "intercalado" entre dos anillos de ciclopentadienilo (Cp). Las longitudes del enlace Co-C son aproximadamente 2,1 Å, un poco más largas que el enlace Fe-C en el ferroceno.
El Co (C 5 H 5 ) 2 pertenece a un grupo de compuestos organometálicos llamados metalocenos o compuestos sándwich. El cobaltoceno tiene 19 electrones de valencia, uno más de los que se encuentran habitualmente en los complejos metálicos de organotransición como su ferroceno relativo muy estable. (Consulte la regla de los 18 electrones ). Este electrón adicional ocupa un orbital que se antienlaza con respecto a los enlaces Co-C. En consecuencia, las distancias Co-C son ligeramente más largas que los enlaces Fe-C en el ferroceno. Muchas reacciones químicas del Co (C 5 H 5 ) 2 se caracterizan por su tendencia a perder este electrón "extra", produciendo un catión de 18 electrones conocido como cobaltocenio:
El pariente cercano del cobaltoceno, el rodoceno , no existe como monómero, sino que se dimeriza espontáneamente mediante la formación de un enlace C – C entre los anillos Cp.
Reacciones
Propiedades redox
El Co (C 5 H 5 ) 2 es un agente reductor de un electrón común en el laboratorio. De hecho, la reversibilidad del par redox Co (C 5 H 5 ) 2 se comporta tan bien que el Co (C 5 H 5 ) 2 puede usarse en voltamperometría cíclica como patrón interno . Su análogo permetilado decametilcobaltoceno (Co (C 5 Me 5 ) 2 ) es un agente reductor especialmente poderoso, debido a la donación inductiva de densidad electrónica de los 10 grupos metilo, lo que hace que el cobalto ceda aún más su electrón "extra". Estos dos compuestos son raros ejemplos de reductores que se disuelven en disolventes orgánicos no polares. Los potenciales de reducción de estos compuestos siguen, usando el par ferroceno- ferrocenio como referencia:
| Media reacción | E 0 (V) |
|---|---|
|
Fe (C 5H 5)+ 2+ e - ⇌ Fe (C 5 H 5 ) 2 |
0,00 (por definición) |
|
Fe (C 5Yo 5)+ 2+ e - ⇌ Fe (C 5 Me 5 ) 2 |
−0,59 |
|
Co (C 5H 5)+ 2+ e - ⇌ Co (C 5 H 5 ) 2 |
−1,33 |
|
Co (C 5Yo 5)+ 2+ e - ⇌ Co (C 5 Me 5 ) 2 |
−1,94 |
Los datos muestran que los compuestos de decametilo son alrededor de 600 mV más reductores que los metalocenos originales. Sin embargo, este efecto sustituyente se ve ensombrecido por la influencia del metal: el cambio de Fe a Co hace que la reducción sea más favorable en más de 1,3 voltios.
Carbonilación
El tratamiento de Co (C 5 H 5 ) 2 con monóxido de carbono da el derivado de cobalto (I) Co (C 5 H 5 ) (CO) 2 , concomitante con la pérdida de un ligando Cp. Esta conversión se realiza cerca de 130 ° C con 500 psi de CO.