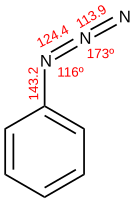Azida - Azide
Azida es el anión con la fórmula N-
3. Es la base conjugada del ácido hidrazoico (HN 3 ). norte-
3es un anión lineal isoelectrónico con CO 2 , NCO - , N 2 O , NO+
2y NCF . Según la teoría del enlace de valencia , la azida puede describirse mediante varias estructuras de resonancia ; un ser importante . La azida también es un grupo funcional en química orgánica , RN 3 .
La aplicación dominante de azidas es como propulsor en bolsas de aire .
Historia
La fenil azida ("diazoamidobenzol") fue preparada en 1864 por Peter Griess mediante la reacción de amoniaco y fenildiazonio . En la década de 1890, Theodor Curtius , que había descubierto el ácido hidrazoico (HN 3 ), describió el reordenamiento de las acil azidas en isocianatos, posteriormente denominado reordenamiento de Curtius . Rolf Huisgen describió la cicloadición 1,3-dipolar del mismo nombre.
El interés por las azidas entre los químicos orgánicos ha sido relativamente modesto debido a la inestabilidad informada de estos compuestos. La situación ha cambiado drásticamente con el descubrimiento de Sharpless et al. de cicloadiciones (3 + 2) catalizadas por Cu entre azidas orgánicas y alquinos terminales. Los grupos azido y alquino son " bioorthogonales ", lo que significa que no interactúan con los sistemas vivos y, al mismo tiempo, experimentan un acoplamiento impresionantemente rápido y selectivo. Este tipo de cicloadición 1,3-dipolar formal se convirtió en el ejemplo más famoso de la llamada " química del clic " (quizás, la única conocida por un no especialista), y el campo de las azidas orgánicas explotó.
Preparación
Azidas inorgánicas
La azida de sodio se fabrica industrialmente mediante la reacción de óxido nitroso , N 2 O con amida de sodio en amoníaco líquido como disolvente:
- N 2 O + 2 NaNH 2 → NaN 3 + NaOH + NH 3
Se pueden preparar muchas azidas inorgánicas directa o indirectamente a partir de azida sódica. Por ejemplo, la azida de plomo , utilizada en detonadores , se puede preparar a partir de la reacción de metátesis entre nitrato de plomo y azida de sodio. Una ruta alternativa es la reacción directa del metal con azida de plata disuelta en amoníaco líquido. Algunas azidas se producen al tratar las sales de carbonato con ácido hidrazoico .

Azidas orgánicas
Como pseudohaluro , la azida generalmente desplaza muchos grupos salientes (p. Ej., Br - , I - , OTs - ) para dar el compuesto azido. Las aril azidas se pueden preparar mediante el desplazamiento de la sal de diazonio apropiada con azida sódica o trimetilsilil azida ; También es posible la sustitución aromática nucleófila , incluso con cloruros. Las anilinas y las hidracinas aromáticas se someten a diazotación , al igual que las alquilaminas e hidrazinas.
Los compuestos alifáticos apropiadamente funcionalizados experimentan sustitución nucleofílica con azida de sodio. Los alcoholes alifáticos dan azidas a través de una variante de la reacción de Mitsunobu , con el uso de ácido hidrazoico . Las hidracinas también pueden formar azidas por reacción con nitrito de sodio :
- PhNHNH 2 + NaNO 2 → PhN 3
Los cloruros de alquil o aril acil reaccionan con azida de sodio en solución acuosa para dar acil azidas , que dan isocianatos en la transposición de Curtius .
Los compuestos de transferencia azo, trifluorometanosulfonil azida e imidazol-1-sulfonil azida , también se preparan a partir de azida sódica. Reaccionan con las aminas para dar las azidas correspondientes:
- RNH 2 → RN 3
En el siguiente esquema se describen algunos métodos comunes para la síntesis de alquil azidas. Sin duda, la sustitución nucleofílica simple de un grupo saliente adecuado con un anión azida sigue siendo el método de elección. El grupo saliente puede ser haluro , sulfonato y otros. La fuente de azida es con mayor frecuencia azida de sodio (NaN 3 ), aunque se han utilizado azida de litio (LiN 3 ), azida de trimetilsililo (TMSN 3 ) y azida de tributilestaño (Bu 3 SnN 3 ). También se conocen modificaciones por microondas y enantioselectivas de la reacción. Los alcoholes se pueden convertir en azidas en un solo paso usando hexafluorofosfato de 2-azido-1,3-dimetilimidazolinio (ADMP) o en condiciones de Mitsunobu con difenilfosforilazida (DPPA). Las hidroxi y aminoazidas son accesibles mediante la escisión del anillo de epóxido y aziridina, respectivamente. Se ha informado de la transferencia de diazo sobre aminas usando trifluorometanosulfonil azida TfN 3 y Tosil azida (TsN 3 ). En los últimos años, la hidroazidación directa de alquenos se ha vuelto cada vez más popular.
Reacción de Dutt-Wormall
Un método clásico para la síntesis de azidas es la reacción de Dutt-Wormall en la que una sal de diazonio reacciona con una sulfonamida primero a un diazoaminosulfinato y luego en la hidrólisis de la azida y un ácido sulfínico .
Reacciones
Azidas inorgánicas
Las sales de azida se pueden descomponer con la liberación de gas nitrógeno. Las temperaturas de descomposición de las azidas de metales alcalinos son: NaN 3 (275 ° C), KN 3 (355 ° C), RbN 3 (395 ° C) y CsN 3 (390 ° C). Este método se utiliza para producir metales alcalinos ultrapuros.
La protonación de sales de azida produce ácido hidrazoico tóxico en presencia de ácidos fuertes:
- H + + N-
3 → HN 3
Las sales de azida pueden reaccionar con metales pesados o compuestos de metales pesados para dar las azidas correspondientes, que son más sensibles a los golpes que la azida de sodio sola. Se descomponen con nitrito de sodio cuando se acidifican. Este es un método para destruir las azidas residuales, antes de su eliminación.
- 2 NaN 3 + 2 HNO 2 → 3 N 2 + 2 NO + 2 NaOH
Se han descrito muchas azidas covalentes inorgánicas (p. Ej., Azidas de cloro, bromo y yodo).
El anión azida se comporta como un nucleófilo; sufre sustitución nucleofílica tanto para sistemas alifáticos como aromáticos. Reacciona con epóxidos, provocando la apertura del anillo; sufre una adición conjugada similar a la de Michael a compuestos de carbonilo 1,4-insaturados.
Las azidas se pueden usar como precursores de los complejos de nitrido metálico al ser inducidas a liberar N 2 , generando un complejo metálico en estados de oxidación inusuales (ver hierro de alta valencia ).
Azidas orgánicas
Las azidas orgánicas participan en reacciones orgánicas útiles . El nitrógeno terminal es levemente nucleófilo. Las azidas extruyen fácilmente nitrógeno diatómico , una tendencia que se explota en muchas reacciones como la ligadura de Staudinger o la transposición de Curtius .
Las azidas se pueden reducir a aminas mediante hidrogenólisis o con una fosfina (por ejemplo, trifenilfosfina ) en la reacción de Staudinger . Esta reacción permite que las azidas sirvan como sintones -NH 2 protegidos , como lo ilustra la síntesis de 1,1,1-tris (aminometil) etano :
- 3 H 2 + CH 3 C (CH 2 N 3 ) 3 → CH 3 C (CH 2 NH 2 ) 3 + 3 N 2
En la cicloadición de azida alquino Huisgen , las azidas orgánicas reaccionan como 1,3-dipolos , reaccionando con alquinos para dar 1,2,3-triazoles sustituidos .
Otra azida regular es la tosilazida aquí en reacción con norbornadieno en una reacción de inserción de nitrógeno:
Aplicaciones
Aproximadamente 250 toneladas de compuestos que contienen azidas se producen anualmente, siendo el producto principal la azida de sodio.
Detonadores y propulsores
La azida de sodio es el propulsor de los airbags de los automóviles . Se descompone al calentarlo para producir gas nitrógeno, que se utiliza para expandir rápidamente la bolsa de aire:
- 2 NaN 3 → 2 Na + 3 N 2
Las sales de metales pesados, como la azida de plomo , Pb (N 3 ) 2 , son detonadores sensibles a los golpes que se descomponen en el correspondiente metal y nitrógeno, por ejemplo:
- Pb (N 3 ) 2 → Pb + 3 N 2
Las sales de plata y bario se utilizan de manera similar. Algunas azidas orgánicas son propulsores de cohetes potenciales, un ejemplo es la 2-dimetilaminoetilazida (DMAZ).
Otro
Debido a los peligros asociados con su uso, pocas azidas se utilizan comercialmente, aunque presentan una reactividad interesante para los investigadores. Las azidas de bajo peso molecular se consideran especialmente peligrosas y se evitan. En el laboratorio de investigación, las azidas son precursoras de las aminas . También son populares por su participación en la " reacción de clic " y en la ligadura de Staudinger . Estas dos reacciones son generalmente bastante fiables y se prestan a la química combinatoria .
Algunas azidas son valiosas como indicadores químicos bioortogonales , moléculas en las que se puede "hacer clic" para ver el camino metabólico que han tomado dentro de un sistema vivo.
El medicamento antivírico zidovudina (AZT) contiene un grupo azido.
La azida de sodio se utiliza como biocida para prevenir perturbaciones y artefactos del crecimiento microbiano incontrolado en experimentos de laboratorio (soluciones acuosas, suspensiones, lodos ...).
La seguridad
- Las azidas son explosóforos y toxinas.
- La azida sódica es tóxico (como cianuro de sodio ) (con un vehículo oral LD 50 de 27 mg / kg en ratas) y puede ser absorbido por la piel. Se descompone explosivamente al calentarse por encima de 275 ° C y reacciona vigorosamente con CS 2 , bromo , ácido nítrico , sulfato de dimetilo y una serie de metales pesados, incluidos el cobre y el plomo . En reacción con los ácidos de Brønsted, se libera azida de hidrógeno altamente tóxica y explosiva .
- Las azidas de metales pesados, como la azida de plomo, son explosivos primarios de alta potencia detonables cuando se calientan o agitan. Las azidas de metales pesados se forman cuando soluciones de azida de sodio o vapores de HN 3 entran en contacto con metales pesados o sus sales. Las azidas de metales pesados pueden acumularse en determinadas circunstancias, por ejemplo, en tuberías metálicas y en los componentes metálicos de diversos equipos ( evaporadores rotativos , equipos de liofilización , trampas de enfriamiento, baños de agua, tuberías de desagüe) y, por lo tanto, provocar explosiones violentas.
- Algunas azidas orgánicas y otras azidas covalentes se clasifican como altamente explosivas y tóxicas: las azidas inorgánicas como neurotoxinas; Los iones azida, como los iones cianuro , se comportan como inhibidores de la citocromo c oxidasa .
- Se ha informado que los reactivos de azida sódica y azida unida a polímero reaccionan con di- y trihalometanos para formar di- y triazidometano, respectivamente, que son inestables sin ser manipulados en soluciones. Se han reportado varias explosiones durante la concentración de mezclas de reacción en evaporadores rotativos. Los peligros del diazidometano (y el triazidometano) están bien documentados.
- Las azidas halógenas sólidas son muy explosivas y no deben prepararse en ausencia de disolvente.
Ver también
Referencias
![]() Este artículo incorpora texto de Oleksandr Zhurakovskyi disponible bajo la licencia CC BY 2.5 .
Este artículo incorpora texto de Oleksandr Zhurakovskyi disponible bajo la licencia CC BY 2.5 .
enlaces externos
- Síntesis de azidas orgánicas , métodos recientes.
- Sintetizar, purificar y manipular azidas orgánicas