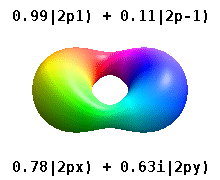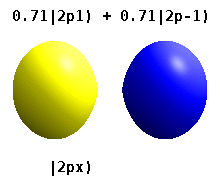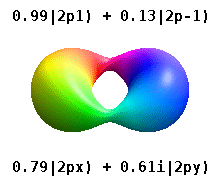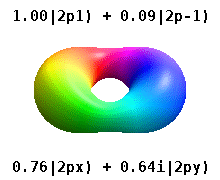Orbital atómico - Atomic orbital

En teoría atómica y mecánica cuántica , un orbital atómico es una función matemática que describe la ubicación y el comportamiento ondulatorio de un electrón en un átomo . Esta función se puede utilizar para calcular la probabilidad de encontrar cualquier electrón de un átomo en cualquier región específica alrededor del núcleo del átomo . El término orbital atómico también puede referirse a la región o espacio físico donde se puede calcular que el electrón está presente, como predice la forma matemática particular del orbital.
Cada orbital en un átomo se caracteriza por un conjunto único de valores de los tres números cuánticos n , ℓ y m l , que corresponden respectivamente a la energía del electrón , el momento angular y un componente del vector del momento angular (el número cuántico magnético ). Cada uno de esos orbitales puede estar ocupado por un máximo de dos electrones, cada uno con su propia proyección de giro . Los nombres simples s orbital , p orbital , d orbital y f orbital se refieren a orbitales con número cuántico de momento angular ℓ = 0, 1, 2 y 3 respectivamente. Estos nombres, junto con el valor de n , se utilizan para describir las configuraciones electrónicas de los átomos. Se derivan de la descripción por los primeros espectroscopistas de cierta serie de metales alcalinos líneas espectroscópicas como s arpa , p rincipal , d iffuse , y f undamental . Los orbitales para ℓ > 3 continúan alfabéticamente, omitiendo j (g, h, i, k, ...) porque algunos idiomas no distinguen entre las letras "i" y "j".
Los orbitales atómicos son los componentes básicos del modelo orbital atómico (conocido alternativamente como nube de electrones o modelo de mecánica de ondas), un marco moderno para visualizar el comportamiento submicroscópico de los electrones en la materia. En este modelo, la nube de electrones de un átomo de múltiples electrones puede verse como formada (en aproximación) en una configuración electrónica que es un producto de orbitales atómicos similares al hidrógeno más simples . La periodicidad de repetición de los bloques de 2, 6, 10 y 14 elementos dentro de las secciones de la tabla periódica surge naturalmente del número total de electrones que ocupan un conjunto completo de orbitales atómicos s , p , d y f , respectivamente, aunque para valores más altos del número cuántico n , particularmente cuando el átomo en cuestión tiene una carga positiva, las energías de ciertas subcapas se vuelven muy similares y, por lo tanto, el orden en el que se dice que están pobladas por electrones (por ejemplo, Cr = [Ar ] 4s 1 3d 5 y Cr 2+ = [Ar] 3d 4 ) sólo se pueden racionalizar de forma un tanto arbitraria.
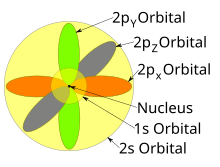
Propiedades de los electrones
Con el desarrollo de la mecánica cuántica y los hallazgos experimentales (como la difracción de electrones en dos rendijas), se descubrió que los electrones en órbita alrededor de un núcleo no podían describirse completamente como partículas, sino que debían explicarse mediante la dualidad onda-partícula . En este sentido, los electrones tienen las siguientes propiedades:
Propiedades onduladas:
- Los electrones no orbitan el núcleo como un planeta que orbita el sol, sino que existen como ondas estacionarias . Por lo tanto, la energía más baja posible que puede tomar un electrón es similar a la frecuencia fundamental de una onda en una cuerda. Los estados de mayor energía son similares a los armónicos de esa frecuencia fundamental.
- Los electrones nunca están en una ubicación de un solo punto, aunque la probabilidad de interactuar con el electrón en un solo punto se puede encontrar a partir de la función de onda del electrón. La carga del electrón actúa como si estuviera manchada en el espacio en una distribución continua, proporcional en cualquier punto a la magnitud al cuadrado de la función de onda del electrón .
Propiedades similares a partículas:
- El número de electrones que orbitan alrededor del núcleo solo puede ser un número entero.
- Los electrones saltan entre orbitales como partículas. Por ejemplo, si un solo fotón golpea los electrones, solo un solo electrón cambia de estado en respuesta al fotón.
- Los electrones retienen propiedades similares a las de las partículas, tales como: cada estado de onda tiene la misma carga eléctrica que su partícula de electrones. Cada estado de onda tiene un solo giro discreto (giro hacia arriba o hacia abajo) dependiendo de su superposición .
Por tanto, los electrones no pueden describirse simplemente como partículas sólidas. Una analogía podría ser la de una "atmósfera" grande y a menudo de forma extraña (el electrón), distribuida alrededor de un planeta relativamente pequeño (el núcleo atómico). Los orbitales atómicos describen exactamente la forma de esta "atmósfera" sólo cuando un solo electrón está presente en un átomo. Cuando se agregan más electrones a un solo átomo, los electrones adicionales tienden a llenar de manera más uniforme un volumen de espacio alrededor del núcleo, de modo que la colección resultante (a veces denominada "nube de electrones" del átomo) tiende hacia una zona de probabilidad generalmente esférica que describe ubicación del electrón, debido al principio de incertidumbre .
Definición formal de mecánica cuántica
Los orbitales atómicos pueden definirse con mayor precisión en el lenguaje formal de la mecánica cuántica . Son una solución aproximada de la ecuación de Schrodinger para los electrones unidos al átomo por el campo eléctrico del núcleo del átomo . Específicamente, en la mecánica cuántica, el estado de un átomo, es decir, un estado propio del hamiltoniano atómico , se aproxima por una expansión (ver expansión de interacción de configuración y conjunto de bases ) en combinaciones lineales de productos antisimetrizados ( determinantes de Slater ) de uno- funciones electrónicas. Los componentes espaciales de estas funciones de un electrón se denominan orbitales atómicos. (Cuando se considera también su componente de espín , se habla de orbitales de espín atómico .) Un estado es en realidad una función de las coordenadas de todos los electrones, de modo que su movimiento está correlacionado, pero esto a menudo se aproxima mediante este modelo de partículas independientes de productos de funciones de onda de un solo electrón. (La fuerza de dispersión de London , por ejemplo, depende de las correlaciones del movimiento de los electrones).
En física atómica , las líneas espectrales atómicas corresponden a transiciones ( saltos cuánticos ) entre estados cuánticos de un átomo. Estos estados están etiquetados por un conjunto de números cuánticos resumidos en el término símbolo y generalmente asociados con configuraciones electrónicas particulares, es decir, por esquemas de ocupación de orbitales atómicos (por ejemplo, 1s 2 2s 2 2p 6 para el estado fundamental del símbolo de término de neón : 1 S 0 ).
Esta notación significa que los determinantes de Slater correspondientes tienen un peso claramente mayor en la expansión de interacción de configuración . El concepto de orbital atómico es, por tanto, un concepto clave para visualizar el proceso de excitación asociado con una transición determinada . Por ejemplo, se puede decir para una transición dada que corresponde a la excitación de un electrón de un orbital ocupado a un orbital desocupado dado. Sin embargo, hay que tener en cuenta que los electrones son fermiones regidos por el principio de exclusión de Pauli y no pueden distinguirse entre sí. Además, a veces sucede que la expansión de la interacción de configuración converge muy lentamente y que no se puede hablar en absoluto de una función de onda simple de un determinante. Este es el caso cuando la correlación de electrones es grande.
Básicamente, un orbital atómico es una función de onda de un electrón, aunque la mayoría de los electrones no existen en átomos de un electrón, por lo que la visión de un electrón es una aproximación. Cuando pensamos en los orbitales, a menudo se nos da una visualización orbital fuertemente influenciada por la aproximación de Hartree-Fock , que es una forma de reducir las complejidades de la teoría de los orbitales moleculares .
Tipos de orbitales

Los orbitales atómicos pueden ser los "orbitales" similares al hidrógeno que son soluciones exactas de la ecuación de Schrödinger para un "átomo" similar al hidrógeno (es decir, un átomo con un electrón). Alternativamente, los orbitales atómicos se refieren a funciones que dependen de las coordenadas de un electrón (es decir, orbitales) pero se usan como puntos de partida para aproximar funciones de onda que dependen de las coordenadas simultáneas de todos los electrones en un átomo o molécula. Los sistemas de coordenadas elegidos para los orbitales atómicos suelen ser coordenadas esféricas ( r , θ, φ) en átomos y cartesianas (x, y, z) en moléculas poliatómicas. La ventaja de las coordenadas esféricas (para átomos) es que una función de onda orbital es un producto de tres factores, cada uno de los cuales depende de una sola coordenada: ψ ( r , θ, φ) = R ( r ) Θ (θ) Φ (φ) . Los factores angulares de orbitales atómicos Θ (θ) Φ (φ) generar s, p, d, etc. funciona como combinaciones reales de armónicos esféricos Y ℓm (θ, Phi) (donde ℓ y m son números cuánticos). Por lo general, existen tres formas matemáticas para las funciones radiales R ( r ) que se pueden elegir como punto de partida para el cálculo de las propiedades de átomos y moléculas con muchos electrones:
- Los orbitales atómicos similares al hidrógeno se derivan de la solución exacta de la Ecuación de Schrödinger para un electrón y un núcleo, para un átomo similar al hidrógeno . La parte de la función que depende de la distancia r del núcleo tiene nodos (nodos radiales) y decae como e - (constante × distancia) .
- El orbital de tipo Slater (STO) es una forma sin nodos radiales, pero se desintegra del núcleo al igual que el orbital similar al hidrógeno.
- La forma del orbital de tipo gaussiano (gaussianos) no tiene nodos radiales y se desintegra como .
Aunque los orbitales similares al hidrógeno todavía se utilizan como herramientas pedagógicas, el advenimiento de las computadoras ha hecho que las STO sean preferibles para los átomos y las moléculas diatómicas, ya que las combinaciones de STO pueden reemplazar los nodos en un orbital atómico similar al hidrógeno. Los gaussianos se utilizan normalmente en moléculas con tres o más átomos. Aunque no son tan precisos por sí mismos como los STO, las combinaciones de muchos gaussianos pueden alcanzar la precisión de los orbitales similares al hidrógeno.
Historia
El término "orbital" fue acuñado por Robert Mulliken en 1932 como una abreviatura de la función de onda orbital de un electrón . Sin embargo, la idea de que los electrones podrían girar alrededor de un núcleo compacto con momento angular definido fue argumentada de manera convincente al menos 19 años antes por Niels Bohr , y el físico japonés Hantaro Nagaoka publicó una hipótesis basada en la órbita para el comportamiento electrónico ya en 1904. Explicando el El comportamiento de estas "órbitas" electrónicas fue una de las fuerzas impulsoras detrás del desarrollo de la mecánica cuántica .
Primeros modelos
Con el descubrimiento del electrón por JJ Thomson en 1897, quedó claro que los átomos no eran los bloques de construcción más pequeños de la naturaleza, sino más bien partículas compuestas. La estructura recién descubierta dentro de los átomos tentó a muchos a imaginar cómo las partes constituyentes del átomo podrían interactuar entre sí. Thomson teorizó que múltiples electrones giraban en anillos con forma de órbita dentro de una sustancia gelatinosa cargada positivamente, y entre el descubrimiento del electrón y 1909, este " modelo de pudín de ciruela " fue la explicación más aceptada de la estructura atómica.
Poco después del descubrimiento de Thomson, Hantaro Nagaoka predijo un modelo diferente para la estructura electrónica. A diferencia del modelo de pudín de ciruela, la carga positiva en el "Modelo de Saturno" de Nagaoka se concentró en un núcleo central, tirando de los electrones en órbitas circulares que recuerdan a los anillos de Saturno. Pocas personas se dieron cuenta del trabajo de Nagaoka en ese momento, y el propio Nagaoka reconoció un defecto fundamental en la teoría incluso en su concepción, a saber, que un objeto cargado clásico no puede sostener el movimiento orbital porque está acelerando y, por lo tanto, pierde energía debido a la radiación electromagnética. Sin embargo, el modelo de Saturno resultó tener más en común con la teoría moderna que cualquiera de sus contemporáneos.
Átomo de Bohr
En 1909, Ernest Rutherford descubrió que la mayor parte de la masa atómica estaba fuertemente condensada en un núcleo, que también se encontró cargado positivamente. De su análisis en 1911 quedó claro que el modelo del pudín de ciruela no podía explicar la estructura atómica. En 1913, el estudiante postdoctoral de Rutherford, Niels Bohr , propuso un nuevo modelo del átomo, en el que los electrones orbitaban el núcleo con períodos clásicos, pero solo se les permitía tener valores discretos de momento angular, cuantificados en unidades h / 2π . Esta restricción permitía automáticamente solo ciertos valores de energías electrónicas. El modelo de Bohr del átomo solucionó el problema de la pérdida de energía por radiación de un estado fundamental (al declarar que no había ningún estado por debajo de este) y, lo que es más importante, explicó el origen de las líneas espectrales.
Después de que Bohr utilizara la explicación de Einstein del efecto fotoeléctrico para relacionar los niveles de energía en los átomos con la longitud de onda de la luz emitida, la conexión entre la estructura de los electrones en los átomos y los espectros de emisión y absorción de los átomos se convirtió en una herramienta cada vez más útil para comprender de electrones en átomos. La característica más destacada de los espectros de emisión y absorción (conocida experimentalmente desde mediados del siglo XIX) era que estos espectros atómicos contenían líneas discretas. La importancia del modelo de Bohr fue que relacionaba las líneas en los espectros de emisión y absorción con las diferencias de energía entre las órbitas que los electrones podían tomar alrededor de un átomo. Sin embargo, esto no lo logró Bohr dándole a los electrones algún tipo de propiedades onduladas, ya que la idea de que los electrones pudieran comportarse como ondas de materia no se sugirió hasta once años después. Aún así, el uso del modelo de Bohr de momentos angulares cuantificados y, por lo tanto, niveles de energía cuantificados fue un paso significativo hacia la comprensión de los electrones en los átomos, y también un paso significativo hacia el desarrollo de la mecánica cuántica al sugerir que las restricciones cuantificadas deben tener en cuenta todos los niveles de energía discontinuos. y espectros en átomos.
Con la sugerencia de De Broglie de la existencia de ondas de materia electrónica en 1924, y durante un corto tiempo antes del tratamiento completo de la ecuación de Schrödinger de 1926 de átomos similares al hidrógeno , se podría considerar que la "longitud de onda" de un electrón de Bohr es una función de su momento. , y así se vio que un electrón en órbita de Bohr orbitaba en un círculo en un múltiplo de su media longitud de onda. El modelo de Bohr durante un corto período de tiempo podría verse como un modelo clásico con una restricción adicional proporcionada por el argumento de la "longitud de onda". Sin embargo, este período fue inmediatamente reemplazado por la mecánica ondulatoria tridimensional completa de 1926. En nuestra comprensión actual de la física, el modelo de Bohr se denomina modelo semiclásico debido a su cuantificación del momento angular, no principalmente por su relación con longitud de onda del electrón, que apareció en retrospectiva una docena de años después de que se propuso el modelo de Bohr.
El modelo de Bohr pudo explicar los espectros de emisión y absorción de hidrógeno . Las energías de los electrones en los estados n = 1, 2, 3, etc. en el modelo de Bohr coinciden con las de la física actual. Sin embargo, esto no explica las similitudes entre diferentes átomos, como lo expresa la tabla periódica, como el hecho de que el helio (dos electrones), el neón (10 electrones) y el argón (18 electrones) exhiben una inercia química similar. La mecánica cuántica moderna explica esto en términos de capas y subcapas de electrones, cada una de las cuales puede contener un número de electrones determinado por el principio de exclusión de Pauli . Por lo tanto, el estado n = 1 puede contener uno o dos electrones, mientras que el estado n = 2 puede contener hasta ocho electrones en las subcapas 2s y 2p. En helio, todos los estados n = 1 están completamente ocupados; lo mismo es cierto para n = 1 y n = 2 en neón. En el argón, las subcapas 3s y 3p están igualmente ocupadas por completo por ocho electrones; La mecánica cuántica también permite una subcapa 3d pero esta tiene una energía más alta que las 3s y 3p en el argón (al contrario de la situación en el átomo de hidrógeno) y permanece vacía.
Concepciones modernas y conexiones con el principio de incertidumbre de Heisenberg
Inmediatamente después de que Heisenberg descubriera su principio de incertidumbre , Bohr señaló que la existencia de cualquier tipo de paquete de ondas implica incertidumbre en la frecuencia y longitud de onda, ya que se necesita una extensión de frecuencias para crear el paquete en sí. En la mecánica cuántica, donde todos los momentos de las partículas están asociados con ondas, es la formación de dicho paquete de ondas lo que localiza la onda, y por tanto la partícula, en el espacio. En los estados donde una partícula de la mecánica cuántica está ligada, debe localizarse como un paquete de ondas, y la existencia del paquete y su tamaño mínimo implica una extensión y un valor mínimo en la longitud de onda de la partícula y, por lo tanto, también el momento y la energía. En mecánica cuántica, como una partícula se localiza en una región más pequeña en el espacio, el paquete de ondas comprimido asociado requiere un rango cada vez mayor de momentos y, por lo tanto, una mayor energía cinética. Por lo tanto, la energía de enlace para contener o atrapar una partícula en una región más pequeña del espacio aumenta sin límite a medida que la región del espacio se hace más pequeña. Las partículas no se pueden restringir a un punto geométrico en el espacio, ya que esto requeriría un momento de partícula infinito.
En química, Schrödinger , Pauling , Mulliken y otros señalaron que la consecuencia de la relación de Heisenberg era que no se podía considerar que el electrón, como paquete de ondas, tuviera una ubicación exacta en su orbital. Max Born sugirió que la posición del electrón necesitaba ser descrita por una distribución de probabilidad que estaba relacionada con encontrar el electrón en algún punto de la función de onda que describía su paquete de ondas asociado. La nueva mecánica cuántica no dio resultados exactos, sino solo las probabilidades de que ocurra una variedad de posibles tales resultados. Heisenberg sostuvo que el camino de una partícula en movimiento no tiene significado si no podemos observarlo, como no podemos con los electrones en un átomo.
En la imagen cuántica de Heisenberg, Schrödinger y otros, el número n del átomo de Bohr para cada orbital se conoció como una esfera n en un átomo tridimensional y se representó como la energía más probable de la nube de probabilidad del paquete de ondas del electrón que Rodeó el átomo.
Nombres orbitales
Notación orbital y subcapas
A los orbitales se les han dado nombres, que generalmente se dan en la forma:
donde X es el nivel de energía correspondiente al número cuántico principal n ; tipo es una letra minúscula que indica la forma o subcapa del orbital, correspondiente al número cuántico de momento angular ℓ .
Por ejemplo, el orbital 1s (pronunciado como números y letras individuales: "'one' 'ess'") es el nivel de energía más bajo ( n = 1 ) y tiene un número cuántico angular de ℓ = 0 , denotado como s. Los orbitales con ℓ = 1, 2 y 3 se denotan como p, dy f respectivamente.
El conjunto de orbitales para un n y ℓ dados se llama subcapa , denotado
- .
El exponente y muestra el número de electrones en la subcapa. Por ejemplo, la notación 2p 4 indica que la subcapa 2p de un átomo contiene 4 electrones. Esta subcapa tiene 3 orbitales, cada uno con n = 2 y ℓ = 1.
Notación de rayos X
También existe otro sistema menos común que todavía se usa en la ciencia de los rayos X conocido como notación de rayos X , que es una continuación de las notaciones utilizadas antes de que se entendiera bien la teoría orbital. En este sistema, al número cuántico principal se le asigna una letra asociada. Para n = 1, 2, 3, 4, 5,… , las letras asociadas con esos números son K, L, M, N, O, ... respectivamente.
Orbitales similares al hidrógeno
Los orbitales atómicos más simples son los que se calculan para sistemas con un solo electrón, como el átomo de hidrógeno . Un átomo de cualquier otro elemento ionizado hasta un solo electrón es muy similar al hidrógeno, y los orbitales toman la misma forma. En la ecuación de Schrödinger para este sistema de una partícula negativa y una positiva, los orbitales atómicos son los estados propios del operador hamiltoniano de la energía. Se pueden obtener analíticamente, lo que significa que los orbitales resultantes son productos de una serie polinomial y funciones exponenciales y trigonométricas. (ver átomo de hidrógeno ).
Para átomos con dos o más electrones, las ecuaciones que gobiernan solo se pueden resolver con el uso de métodos de aproximación iterativa. Los orbitales de los átomos de varios electrones son cualitativamente similares a los del hidrógeno y, en los modelos más simples, se considera que tienen la misma forma. Para un análisis más riguroso y preciso, se deben utilizar aproximaciones numéricas.
Un orbital atómico dado (similar al hidrógeno) se identifica mediante valores únicos de tres números cuánticos: n , ℓ y m ℓ . Las reglas que restringen los valores de los números cuánticos y sus energías (ver más abajo) explican la configuración electrónica de los átomos y la tabla periódica .
Los estados estacionarios (estados cuánticos ) de los átomos similares al hidrógeno son sus orbitales atómicos. Sin embargo, en general, el comportamiento de un electrón no está completamente descrito por un solo orbital. Los estados de los electrones se representan mejor mediante "mezclas" ( combinaciones lineales ) dependientes del tiempo de múltiples orbitales. Consulte Método de orbitales moleculares de combinación lineal de orbitales atómicos .
El número cuántico n apareció por primera vez en el modelo de Bohr, donde determina el radio de cada órbita circular de electrones. Sin embargo, en la mecánica cuántica moderna, n determina la distancia media del electrón al núcleo; todos los electrones con el mismo valor de n se encuentran a la misma distancia promedio. Por esta razón, se dice que los orbitales con el mismo valor de n comprenden una " capa ". Los orbitales con el mismo valor de ny también el mismo valor de ℓ están aún más estrechamente relacionados y se dice que comprenden una " subcapa ".
Números cuánticos
Debido a la naturaleza mecánica cuántica de los electrones alrededor de un núcleo, los orbitales atómicos se pueden definir de forma única mediante un conjunto de números enteros conocidos como números cuánticos. Estos números cuánticos solo ocurren en ciertas combinaciones de valores, y su interpretación física cambia dependiendo de si se emplean versiones reales o complejas de los orbitales atómicos.
Orbitales complejos
En física, las descripciones orbitales más comunes se basan en las soluciones del átomo de hidrógeno, donde los orbitales están dados por el producto entre una función radial y un armónico esférico puro. Los números cuánticos, junto con las reglas que gobiernan sus posibles valores, son los siguientes:
El número cuántico principal n describe la energía del electrón y siempre es un número entero positivo . De hecho, puede ser cualquier número entero positivo, pero por las razones que se analizan a continuación, rara vez se encuentran números grandes. Cada átomo tiene, en general, muchos orbitales asociados con cada valor de n ; estos orbitales juntos a veces se denominan capas de electrones .
El número cuántico azimutal ℓ describe el momento angular orbital de cada electrón y es un número entero no negativo. Dentro de un shell donde n es un número entero n 0 , ℓ varía entre todos los valores (enteros) que satisfacen la relación . Por ejemplo, el caparazón n = 1 solo tiene orbitales con , y el caparazón n = 2 solo tiene orbitales con , y . El conjunto de orbitales asociados con un valor particular de ℓ a veces se denomina colectivamente subcapa .
El número cuántico magnético , , describe el momento magnético de un electrón en una dirección arbitraria, y también es siempre un número entero. Dentro de una subcapa donde es algún entero , rangos así: .
Los resultados anteriores se pueden resumir en la siguiente tabla. Cada celda representa una subcapa y enumera los valores de disponible en esa subcapa. Las celdas vacías representan subcapas que no existen.
| ℓ = 0 ( s ) | ℓ = 1 ( p ) | ℓ = 2 ( d ) | ℓ = 3 ( f ) | ℓ = 4 ( g ) | ... | |
|---|---|---|---|---|---|---|
| n = 1 | ... | |||||
| n = 2 | 0 | −1, 0, 1 | ... | |||
| n = 3 | 0 | −1, 0, 1 | −2, −1, 0, 1, 2 | ... | ||
| n = 4 | 0 | −1, 0, 1 | −2, −1, 0, 1, 2 | −3, −2, −1, 0, 1, 2, 3 | ... | |
| n = 5 | 0 | −1, 0, 1 | −2, −1, 0, 1, 2 | −3, −2, −1, 0, 1, 2, 3 | −4, −3, −2, −1, 0, 1, 2, 3, 4 | ... |
| ... | ... | ... | ... | ... | ... | ... |
Las subcapas generalmente se identifican por sus valores - y - . está representado por su valor numérico, pero está representado por una letra como sigue: 0 está representado por 's', 1 por 'p', 2 por 'd', 3 por 'f' y 4 por 'g'. Por ejemplo, se puede hablar de la subcapa con y como una 'subcapa 2s'.
Cada electrón también tiene un número cuántico de espín , s , que describe el espín de cada electrón (espín hacia arriba o hacia abajo). El número s puede ser +1/2 o -1/2.
El principio de exclusión de Pauli establece que no hay dos electrones en un átomo que puedan tener los mismos valores de los cuatro números cuánticos. Si hay dos electrones en un orbital con valores dados para tres números cuánticos, ( n , ℓ , m ), estos dos electrones deben diferir en su espín.
Las convenciones anteriores implican un eje preferido (por ejemplo, la dirección z en coordenadas cartesianas) y también implican una dirección preferida a lo largo de este eje preferido. De lo contrario, no tendría sentido distinguir m = +1 de m = −1 . Como tal, el modelo es más útil cuando se aplica a sistemas físicos que comparten estas simetrías. El experimento de Stern-Gerlach , donde un átomo se expone a un campo magnético, proporciona un ejemplo.
Orbitales reales
Un átomo que está incrustado en un sólido cristalino siente múltiples ejes preferidos, pero a menudo ninguna dirección preferida. En lugar de construir orbitales atómicos a partir del producto de funciones radiales y un solo armónico esférico , se utilizan típicamente combinaciones lineales de armónicos esféricos, diseñadas de modo que la parte imaginaria de los armónicos esféricos se cancele. Estos orbitales reales son los bloques de construcción que se muestran con mayor frecuencia en las visualizaciones orbitales.
En el verdadero hidrógeno-como orbitales, por ejemplo, n y ℓ tienen la misma interpretación y el significado como sus homólogos de complejos, pero m ya no es un número cuántico buena (aunque su valor absoluto es). Los orbitales reciben nuevos nombres basados en su forma con respecto a una base cartesiana estandarizada. Los orbitales p reales similares al hidrógeno vienen dados por los siguientes
donde p 0 = R n 1 Y 1 0 , p 1 = R n 1 Y 1 1 , y p −1 = R n 1 Y 1 −1 , son los orbitales complejos correspondientes a ℓ = 1 .
Las ecuaciones para los orbitales p x y p y dependen de la convención de fase utilizada para los armónicos esféricos. Las ecuaciones anteriores suponen que los armónicos esféricos están definidos por . Sin embargo, algunos físicos cuánticos incluyen un factor de fase (-1) m en estas definiciones, que tiene el efecto de relacionar el orbital p x con una diferencia de armónicos esféricos y el orbital p y con la suma correspondiente . (Para obtener más detalles, consulte Armónicos esféricos # Convenciones ).
Formas de orbitales

Las imágenes simples que muestran formas orbitales están destinadas a describir las formas angulares de las regiones en el espacio donde es probable que se encuentren los electrones que ocupan el orbital. Los diagramas no pueden mostrar la región completa donde se puede encontrar un electrón, ya que según la mecánica cuántica existe una probabilidad distinta de cero de encontrar el electrón (casi) en cualquier lugar del espacio. En cambio, los diagramas son representaciones aproximadas de superficies de contorno o contorno donde la densidad de probabilidad | ψ ( r , θ, φ) | 2 tiene un valor constante, elegido de modo que haya una cierta probabilidad (por ejemplo, 90%) de encontrar el electrón dentro del contorno. Aunque | ψ | 2 dado que el cuadrado de un valor absoluto es en todas partes no negativo, el signo de la función de onda ψ ( r , θ, φ) se indica a menudo en cada subregión de la imagen orbital.
A veces, la función ψ se representará gráficamente para mostrar sus fases, en lugar de | ψ ( r , θ, φ) | 2 que muestra densidad de probabilidad pero no tiene fases (que se han perdido en el proceso de tomar el valor absoluto, ya que ψ ( r , θ, φ) es un número complejo). | ψ ( r , θ, φ) | 2 Los gráficos orbitales tienden a tener lóbulos menos esféricos y más delgados que los gráficos ψ ( r , θ, φ) , pero tienen el mismo número de lóbulos en los mismos lugares y, por lo demás, son reconocibles. Este artículo, para mostrar las fases de la función de onda, muestra principalmente gráficos ψ ( r , θ, φ) .
Los lóbulos pueden verse como patrones de interferencia de ondas estacionarias entre los dos modos de onda viajera resonante en anillo " m " y " - m " que giran en sentido contrario , con la proyección del orbital en el plano xy con longitudes de onda " m " resonantes alrededor de la circunferencia . Aunque rara vez se muestran, las soluciones de ondas viajeras pueden verse como toros rotativos con bandas, con las bandas que representan información de fase. Para cada m hay dos soluciones de onda estacionaria ⟨ m ⟩ + ⟨- m ⟩ y ⟨ m ⟩-⟨- m ⟩ . Para el caso en el que m = 0, el orbital es vertical, se desconoce la información de contrarrotación y el orbital es simétrico en el eje z . Para el caso donde ℓ = 0 no hay modos de contrarrotación. Solo hay modos radiales y la forma es esféricamente simétrica. Para cualquier n dado , cuanto más pequeño es ℓ , más nodos radiales hay. Para cualquier ℓ dado , cuanto más pequeño es n , menos nodos radiales hay (cero para el n primero que tenga ese orbital ℓ ). En términos generales, n es energía, ℓ es análogo a excentricidad y m es orientación. En el caso clásico, una onda viajera resonante en anillo, por ejemplo en una línea de transmisión circular, a menos que se la fuerce activamente, se descompondrá espontáneamente en una onda estacionaria resonante en anillo porque los reflejos se acumularán con el tiempo incluso en la imperfección o discontinuidad más pequeña.
En términos generales, el número n determina el tamaño y la energía del orbital para un núcleo dado: a medida que aumenta n , aumenta el tamaño del orbital. Al comparar diferentes elementos, la carga nuclear más alta Z de los elementos más pesados hace que sus orbitales se contraigan en comparación con los más livianos, de modo que el tamaño total de todo el átomo permanece aproximadamente constante, incluso cuando el número de electrones en los elementos más pesados (mayor Z ) aumenta.

También en términos generales, ℓ determina la forma de un orbital y m ℓ su orientación. Sin embargo, dado que algunos orbitales se describen mediante ecuaciones en números complejos , la forma a veces también depende de m ℓ . Juntos, el conjunto de orbitales para un determinado ℓ y n espacio de llenado lo más simétricamente posible, aunque con conjuntos cada vez más complejas de los lóbulos y nodos.
Los orbitales s únicos ( ) tienen forma de esferas. Para n = 1 es aproximadamente una bola sólida (es más densa en el centro y se desvanece exponencialmente hacia afuera), pero para n = 2 o más, cada orbital s está compuesto por superficies esféricamente simétricas que son capas anidadas (es decir, la "estructura de onda" es radial, siguiendo también una componente radial sinusoidal). Vea la ilustración de una sección transversal de estos caparazones anidados, a la derecha. Los orbitales s para todos los n números son los únicos orbitales con un antinodo (una región de alta densidad de función de onda) en el centro del núcleo. Todos los demás orbitales (p, d, f, etc.) tienen momento angular y, por lo tanto, evitan el núcleo (que tiene un nodo de onda en el núcleo). Recientemente, se ha realizado un esfuerzo para obtener imágenes experimentales de los orbitales 1s y 2p en un cristal de SrTiO 3 utilizando microscopía electrónica de transmisión de barrido con espectroscopía de rayos X de energía dispersiva. Debido a que las imágenes se realizaron con un haz de electrones, la interacción entre el haz de Coulombic y la órbita, que a menudo se denomina efecto del parámetro de impacto, se incluye en el resultado final (consulte la figura de la derecha).
Las formas de los orbitales p, d y f se describen verbalmente aquí y se muestran gráficamente en la tabla de Orbitales a continuación. Los tres orbitales p para n = 2 tienen la forma de dos elipsoides con un punto de tangencia en el núcleo (la forma de dos lóbulos a veces se denomina " mancuerna "; hay dos lóbulos apuntando en direcciones opuestas entre sí ). Los tres orbitales p en cada capa están orientados en ángulos rectos entre sí, según lo determinado por su respectiva combinación lineal de valores de m ℓ . El resultado general es un lóbulo que apunta a lo largo de cada dirección de los ejes primarios.
Cuatro de los cinco orbitales d para n = 3 parecen similares, cada uno con cuatro lóbulos en forma de pera, cada lóbulo tangente en ángulo recto a otros dos, y los centros de los cuatro se encuentran en un plano. Tres de estos planos son los planos xy, xz e yz (los lóbulos están entre los pares de ejes primarios) y el cuarto tiene el centro a lo largo de los ejes xey. El quinto y último orbital d consta de tres regiones de alta densidad de probabilidad: un toro entre dos regiones en forma de pera colocadas simétricamente en su eje z. El total general de 18 lóbulos direccionales apunta en cada dirección del eje primario y entre cada par.
Hay siete orbitales f, cada uno con formas más complejas que las de los orbitales d.
Además, como es el caso de los orbitales s, los orbitales p, d, fyg individuales con valores de n más altos que el valor más bajo posible, exhiben una estructura de nodo radial adicional que recuerda a ondas armónicas del mismo tipo, en comparación con el modo más bajo (o fundamental) de la onda. Al igual que con los orbitales s, este fenómeno proporciona orbitales p, d, f y g en el siguiente valor más alto posible de n (por ejemplo, orbitales 3p frente al 2p fundamental), un nodo adicional en cada lóbulo. Los valores aún más altos de n aumentan aún más el número de nodos radiales, para cada tipo de orbital.
Las formas de los orbitales atómicos en un átomo de un electrón están relacionadas con armónicos esféricos tridimensionales . Estas formas no son únicos, y cualquier combinación lineal es válida, como una transformación a armónicos cúbicos , de hecho, es posible generar conjuntos donde todos los d's tienen la misma forma, al igual que el p x , p y , y p z son la misma forma.
Aunque los orbitales individuales suelen mostrarse independientes entre sí, los orbitales coexisten alrededor del núcleo al mismo tiempo. Además, en 1927, Albrecht Unsöld demostró que si se suma la densidad electrónica de todos los orbitales de un número cuántico azimutal particular ℓ de la misma capa n (por ejemplo, los tres orbitales 2p, o los cinco orbitales 3d) donde cada orbital está ocupado por un electrón o cada uno está ocupado por un par de electrones, entonces toda dependencia angular desaparece; es decir, la densidad total resultante de todos los orbitales atómicos en esa subcapa (aquellos con el mismo ℓ ) es esférica. Esto se conoce como teorema de Unsöld .
Mesa de orbitales
Esta tabla muestra todas las configuraciones orbitales para las funciones de onda similares al hidrógeno real hasta 7s y, por lo tanto, cubre la configuración electrónica simple para todos los elementos de la tabla periódica hasta el radio . Los gráficos "ψ" se muestran con las fases de función de onda - y + en dos colores diferentes (arbitrariamente rojo y azul). El orbital p z es el mismo que el orbital p 0 , pero p x y p y se forman tomando combinaciones lineales de los orbitales p +1 y p −1 (por lo que se enumeran bajo la etiqueta m = ± 1 ). Además, p +1 y p −1 no tienen la misma forma que p 0 , ya que son armónicos esféricos puros .
* Aún no se han descubierto elementos con este número cuántico magnético .
† Se han descubierto los elementos con este número cuántico magnético , pero su configuración electrónica es solo una predicción.
‡ La configuración electrónica de los elementos con este número cuántico magnético solo se ha confirmado para un número cuántico de espín de +1/2 .
Comprensión cualitativa de formas.
Las formas de los orbitales atómicos pueden entenderse cualitativamente considerando el caso análogo de ondas estacionarias en un tambor circular . Para ver la analogía, el desplazamiento vibratorio medio de cada trozo de membrana del tambor desde el punto de equilibrio durante muchos ciclos (una medida de la velocidad y el impulso promedio de la membrana del tambor en ese punto) debe considerarse en relación con la distancia de ese punto desde el centro del tambor. cabeza. Si se considera que este desplazamiento es análogo a la probabilidad de encontrar un electrón a una distancia determinada del núcleo, se verá que los muchos modos del disco vibrante forman patrones que trazan las diversas formas de los orbitales atómicos. La razón básica de esta correspondencia radica en el hecho de que la distribución de la energía cinética y el momento en una onda de materia predice dónde estará la partícula asociada con la onda. Es decir, la probabilidad de encontrar un electrón en un lugar dado también es función del momento promedio del electrón en ese punto, ya que el momento elevado del electrón en una posición dada tiende a "localizar" el electrón en esa posición, a través de las propiedades del electrón. paquetes de ondas (consulte el principio de incertidumbre de Heisenberg para obtener detalles del mecanismo).
Esta relación significa que se pueden observar ciertas características clave tanto en los modos de membrana del tambor como en los orbitales atómicos. Por ejemplo, en todos los modos análogos a los orbitales s (la fila superior en la ilustración animada a continuación), se puede ver que el centro mismo de la membrana del tambor vibra con más fuerza, lo que corresponde al antinodo en todos los orbitales s de un átomo. . Este antinodo significa que es más probable que el electrón esté en la posición física del núcleo (a través del cual pasa directamente sin dispersarse ni golpearlo), ya que se mueve (en promedio) más rápidamente en ese punto, lo que le da un impulso máximo.
Una imagen mental de "órbita planetaria" más cercana al comportamiento de los electrones en los orbitales s , todos los cuales no tienen momento angular, podría ser quizás la de una órbita kepleriana con la excentricidad orbital de 1 pero un eje mayor finito, no físicamente posible (porque partículas iban a colisionar), pero se puede imaginar como un límite de órbitas con ejes mayores iguales pero excentricidad creciente.
A continuación, se muestran varios modos de vibración de la membrana del tambor y las respectivas funciones de onda del átomo de hidrógeno. Se puede considerar una correspondencia donde las funciones de onda de un parche de tambor vibrante son para un sistema de dos coordenadas ψ ( r , θ) y las funciones de onda para una esfera vibrante son de tres coordenadas ψ ( r , θ, φ) .
- Modos de batería tipo s y funciones de onda
Ninguno de los otros conjuntos de modos en una membrana de tambor tiene un antinodo central, y en todos ellos el centro del tambor no se mueve. Estos corresponden a un nodo en el núcleo para todos los orbitales no s en un átomo. Todos estos orbitales tienen algún momento angular, y en el modelo planetario, corresponden a partículas en órbita con excentricidad menor a 1.0, de modo que no pasan directamente por el centro del cuerpo primario, sino que se mantienen algo alejadas de él.
Además, los modos de tambor análogos a p y d modos en un átomo muestran irregularidad espacial a lo largo de las diferentes direcciones radiales desde el centro del tambor, mientras que todos los modos análoga a s modos son perfectamente simétrico en dirección radial. Las propiedades de no simetría radial de los orbitales no s son necesarias para localizar una partícula con momento angular y naturaleza ondulatoria en un orbital donde debe tender a mantenerse alejada de la fuerza de atracción central, ya que cualquier partícula localizada en el punto de atracción central no podría tener momento angular. Para estos modos, las ondas en el parche del tambor tienden a evitar el punto central. Estas características enfatizan nuevamente que las formas de los orbitales atómicos son una consecuencia directa de la naturaleza ondulatoria de los electrones.
- Modos de batería tipo p y funciones de onda
- modos de tambor tipo d
Energía orbital
En átomos con un solo electrón ( átomos similares al hidrógeno ), la energía de un orbital (y, en consecuencia, de cualquier electrón en el orbital) está determinada principalmente por . El orbital tiene la menor energía posible en el átomo. Cada valor sucesivamente más alto de tiene un nivel más alto de energía, pero la diferencia disminuye a medida que aumenta. Para alto , el nivel de energía se vuelve tan alto que el electrón puede escapar fácilmente del átomo. En átomos de un solo electrón, todos los niveles con diferentes dentro de un determinado están degenerados en la aproximación de Schrödinger y tienen la misma energía. Esta aproximación se rompe ligeramente en la solución de la ecuación de Dirac (donde la energía depende de ny otro número cuántico j ), y por el efecto del campo magnético del núcleo y los efectos de la electrodinámica cuántica . Estos últimos inducen pequeñas diferencias de energía de enlace, especialmente para los electrones s que se acercan al núcleo, ya que sienten una carga nuclear muy ligeramente diferente, incluso en átomos de un electrón; ver Cordero turno .
En átomos con múltiples electrones, la energía de un electrón depende no solo de las propiedades intrínsecas de su orbital, sino también de sus interacciones con los otros electrones. Estas interacciones dependen del detalle de su distribución de probabilidad espacial, por lo que los niveles de energía de los orbitales dependen no solo de sino también de . Los valores más altos de están asociados con valores más altos de energía; por ejemplo, el estado 2p es más alto que el estado 2s. Cuando , el aumento de energía del orbital se vuelve tan grande como para empujar la energía del orbital por encima de la energía del orbital s en la siguiente capa superior; cuando la energía es empujada hacia el caparazón dos pasos más arriba. El llenado de los orbitales 3d no ocurre hasta que se hayan llenado los orbitales 4s.
El aumento de energía para las subcapas de momento angular creciente en átomos más grandes se debe a los efectos de interacción electrón-electrón, y está específicamente relacionado con la capacidad de los electrones de momento angular bajo para penetrar más eficazmente hacia el núcleo, donde están sujetos a menos apantallamiento. de la carga de los electrones intervinientes. Así, en los átomos de mayor número atómico, la cantidad de electrones se vuelve cada vez más un factor determinante en su energía, y los principales números cuánticos de electrones se vuelven cada vez menos importantes en su ubicación de energía.
La secuencia de energía de las primeras 35 subcapas (por ejemplo, 1s, 2p, 3d, etc.) se da en la siguiente tabla. Cada celda representa una subcapa con y dado por sus índices de fila y columna, respectivamente. El número en la celda es la posición de la subcapa en la secuencia. Para obtener una lista lineal de las subcapas en términos de energías crecientes en átomos de múltiples electrones, consulte la sección siguiente.
|
l
norte
|
s | pag | D | F | gramo | h |
|---|---|---|---|---|---|---|
| 1 | 1 | |||||
| 2 | 2 | 3 | ||||
| 3 | 4 | 5 | 7 | |||
| 4 | 6 | 8 | 10 | 13 | ||
| 5 | 9 | 11 | 14 | 17 | 21 | |
| 6 | 12 | 15 | 18 | 22 | 26 | 31 |
| 7 | dieciséis | 19 | 23 | 27 | 32 | 37 |
| 8 | 20 | 24 | 28 | 33 | 38 | 44 |
| 9 | 25 | 29 | 34 | 39 | 45 | 51 |
| 10 | 30 | 35 | 40 | 46 | 52 | 59 |
Nota: las celdas vacías indican subniveles inexistentes, mientras que los números en cursiva indican subniveles que podrían (potencialmente) existir, pero que no contienen electrones en ningún elemento actualmente conocido.
Colocación de electrones y tabla periódica

Varias reglas gobiernan la ubicación de los electrones en los orbitales ( configuración electrónica ). El primero dicta que dos electrones en un átomo no pueden tener el mismo conjunto de valores de números cuánticos (este es el principio de exclusión de Pauli ). Estos números cuánticos incluyen los tres que definen los orbitales, así como s , o el número cuántico de espín . Por tanto, dos electrones pueden ocupar un solo orbital, siempre que tengan diferentes valores de s . Sin embargo, solo dos electrones, debido a su espín, pueden asociarse con cada orbital.
Además, un electrón siempre tiende a caer al estado de energía más bajo posible. Es posible que ocupe cualquier orbital siempre que no viole el principio de exclusión de Pauli, pero si hay disponibles orbitales de menor energía, esta condición es inestable. El electrón eventualmente perderá energía (al liberar un fotón ) y caerá al orbital inferior. Por lo tanto, los electrones llenan los orbitales en el orden especificado por la secuencia de energía dada anteriormente.
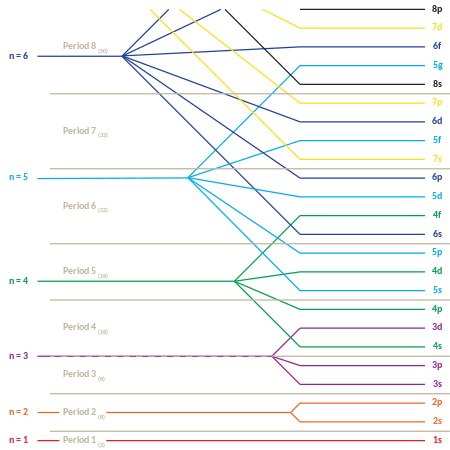
Este comportamiento es responsable de la estructura de la tabla periódica . La tabla se puede dividir en varias filas (llamadas 'períodos'), numeradas comenzando con 1 en la parte superior. Los elementos actualmente conocidos ocupan siete períodos. Si un cierto período tiene el número i , consta de elementos cuyos electrones más externos caen en la i- ésima capa. Niels Bohr fue el primero en proponer (1923) que la periodicidad en las propiedades de los elementos podría explicarse por el llenado periódico de los niveles de energía de los electrones, dando como resultado la estructura electrónica del átomo.
La tabla periódica también se puede dividir en varios ' bloques ' rectangulares numerados . Los elementos que pertenecen a un bloque dado tienen esta característica común: sus electrones de mayor energía pertenecen todos al mismo estado ℓ (pero el n asociado con ese estado ℓ depende del período). Por ejemplo, las dos columnas más a la izquierda constituyen el 'bloque s'. Los electrones más externos de Li y Be pertenecen respectivamente a la subcapa 2s, y los de Na y Mg a la subcapa 3s.
El siguiente es el orden para llenar los orbitales de la "subcapa", que también da el orden de los "bloques" en la tabla periódica:
- 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
La naturaleza "periódica" del relleno de orbitales, así como aparición de los s , p , d , y f "bloques", es más obvio si este orden de llenado se da en forma de matriz, con el aumento de números cuánticos principales a partir de la nuevas filas ("puntos") en la matriz. Luego, cada subcapa (compuesta por los dos primeros números cuánticos) se repite tantas veces como sea necesario para cada par de electrones que pueda contener. El resultado es una tabla periódica comprimida, en la que cada entrada representa dos elementos sucesivos:
| 1 s | |||||||||||||||
| 2 s | 2p | 2p | 2p | ||||||||||||
| 3 s | 3p | 3p | 3p | ||||||||||||
| 4s | 3d | 3d | 3d | 3d | 3d | 4p | 4p | 4p | |||||||
| 5 s | 4d | 4d | 4d | 4d | 4d | 5p | 5p | 5p | |||||||
| 6 s | 4f | 4f | 4f | 4f | 4f | 4f | 4f | 5d | 5d | 5d | 5d | 5d | 6p | 6p | 6p |
| 7 s | 5f | 5f | 5f | 5f | 5f | 5f | 5f | 6d | 6d | 6d | 6d | 6d | 7p | 7p | 7p |
Aunque este es el orden general de llenado orbital de acuerdo con la regla de Madelung, hay excepciones, y las energías electrónicas reales de cada elemento también dependen de detalles adicionales de los átomos (ver Configuración electrónica # Átomos: principio de Aufbau y regla de Madelung ).
El número de electrones en un átomo eléctricamente neutro aumenta con el número atómico . Los electrones en la capa más externa, o electrones de valencia , tienden a ser responsables del comportamiento químico de un elemento. Los elementos que contienen el mismo número de electrones de valencia se pueden agrupar y mostrar propiedades químicas similares.
Efectos relativistas
Para los elementos con un número atómico alto Z , los efectos de la relatividad se vuelven más pronunciados, y especialmente para los electrones s, que se mueven a velocidades relativistas cuando penetran en los electrones apantallados cerca del núcleo de los átomos de Z alto . Este aumento relativista en el momento para los electrones de alta velocidad causa una disminución correspondiente en la longitud de onda y la contracción de los orbitales 6s en relación con los orbitales 5d (en comparación con los electrones syd correspondientes en elementos más ligeros en la misma columna de la tabla periódica); esto da como resultado que los electrones de valencia 6s pierdan energía.
Ejemplos de resultados físicos significativos de este efecto incluyen la temperatura de fusión más baja del mercurio (que resulta de que los electrones 6s no están disponibles para la unión de metales) y el color dorado del oro y el cesio .
En el modelo de Bohr , un electrón n = 1 tiene una velocidad dada por , donde Z es el número atómico, es la constante de estructura fina y c es la velocidad de la luz. En la mecánica cuántica no relativista, por lo tanto, cualquier átomo con un número atómico mayor que 137 requeriría que sus electrones 1s viajen más rápido que la velocidad de la luz. Incluso en la ecuación de Dirac , que explica los efectos relativistas, la función de onda del electrón para los átomos con es oscilatoria e ilimitada . La importancia del elemento 137, también conocido como untriseptium , fue señalada por primera vez por el físico Richard Feynman . El elemento 137 a veces se llama informalmente feynmanium (símbolo Fy). Sin embargo, la aproximación de Feynman falla para predecir el valor crítico exacta de Z debido a la naturaleza no-punto-carga del núcleo y el radio orbital muy pequeña de electrones internos, lo que resulta en un potencial visto por electrones internos que es efectivamente menos Z . El valor crítico de Z , que hace que el átomo sea inestable con respecto a la ruptura de campo alto del vacío y la producción de pares de electrones y positrones, no ocurre hasta que Z es aproximadamente 173. Estas condiciones no se observan excepto de manera transitoria en colisiones de núcleos muy pesados. como plomo o uranio en aceleradores, donde se ha afirmado que se observa la producción de electrones y positrones a partir de estos efectos.
No hay nodos en densidades orbitales relativistas, aunque los componentes individuales de la función de onda tendrán nodos.
pp hibridación (conjetura)
En elementos tardíos del período 8 se espera que exista un híbrido de 8p 3/2 y 9p 1/2 , donde "3/2" y "1/2" se refieren al número cuántico de momento angular total . Este híbrido "pp" puede ser responsable del bloque p del período debido a propiedades similares a las subcapas p en las capas de valencia ordinarias . Los niveles de energía de 8p 3/2 y 9p 1/2 se acercan debido a los efectos relativistas de giro-órbita ; la subcapa 9s también debería participar, ya que se espera que estos elementos sean análogos a los elementos 5p respectivos de indio a xenón .
Transiciones entre orbitales
Los estados cuánticos ligados tienen niveles de energía discretos. Cuando se aplica a los orbitales atómicos, esto significa que las diferencias de energía entre los estados también son discretas. Por tanto, una transición entre estos estados (es decir, un electrón que absorbe o emite un fotón) sólo puede ocurrir si el fotón tiene una energía correspondiente a la diferencia de energía exacta entre dichos estados.
Considere dos estados del átomo de hidrógeno:
Estado 1) n = 1 , ℓ = 0 , m ℓ = 0 y s = +1/2
Estado 2) n = 2 , ℓ = 0 , m ℓ = 0 y s = +1/2
Según la teoría cuántica, el estado 1 tiene una energía fija de E 1 y el estado 2 tiene una energía fija de E 2 . Ahora bien, ¿qué pasaría si un electrón en el estado 1 se moviera al estado 2? Para que esto suceda, el electrón necesitaría ganar una energía de exactamente E 2 - E 1 . Si el electrón recibe energía menor o mayor que este valor, no puede saltar del estado 1 al estado 2. Ahora, suponga que irradiamos el átomo con un amplio espectro de luz. Los fotones que llegan al átomo que tienen una energía de exactamente E 2 - E 1 serán absorbidos por el electrón en el estado 1, y ese electrón saltará al estado 2. Sin embargo, los fotones que tienen una energía mayor o menor no pueden ser absorbidos por el electrón, debido a que el electrón solo puede saltar a uno de los orbitales, no puede saltar a un estado entre orbitales. El resultado es que solo los fotones de una frecuencia específica serán absorbidos por el átomo. Esto crea una línea en el espectro, conocida como línea de absorción, que corresponde a la diferencia de energía entre los estados 1 y 2.
El modelo orbital atómico predice así espectros de línea, que se observan experimentalmente. Esta es una de las principales validaciones del modelo orbital atómico.
Sin embargo, el modelo orbital atómico es una aproximación a la teoría cuántica completa, que solo reconoce muchos estados electrónicos. Las predicciones de los espectros de líneas son cualitativamente útiles pero no cuantitativamente precisas para átomos e iones distintos de los que contienen un solo electrón.
Ver también
Notas
Referencias
- McCaw, Charles S. (2015). Orbitales: con aplicaciones en espectros atómicos . Singapur: World Scientific Publishing Company. ISBN 9781783264162.
- Tipler, Paul; Llewellyn, Ralph (2003). Física moderna (4 ed.). Nueva York: WH Freeman and Company. ISBN 978-0-7167-4345-3.
- Scerri, Eric (2007). La tabla periódica, su historia y su significado . Nueva York: Oxford University Press. ISBN 978-0-19-530573-9.
- Levine, Ira (2014). Química cuántica (7ª ed.). Educación Pearson. ISBN 978-0-321-80345-0.
- Griffiths, David (2000). Introducción a la mecánica cuántica (2 ed.). Benjamin Cummings. ISBN 978-0-13-111892-8.
- Cohen, Irwin; Avutarda, Thomas (1966). "Orbitales atómicos: limitaciones y variaciones". J. Chem. Educ . 43 (4): 187. Código Bibliográfico : 1966JChEd..43..187C . doi : 10.1021 / ed043p187 .
enlaces externos
- Orbitales de hidrógeno 3D en Wikimedia Commons
- Guía de orbitales atómicos
- Enlaces covalentes y estructura molecular
- Animación de la evolución temporal de un orbital hidrogénico
- El Orbitron , una visualización de todos los orbitales atómicos comunes y poco comunes, de 1s a 7g
- Gran mesa Imágenes fijas de muchos orbitales