Trisulfuro de arsénico - Arsenic trisulfide

|
|
|
|
|
|
|
| Nombres | |
|---|---|
|
Nombre IUPAC preferido
Trisulfuro de arsénico |
|
| Otros nombres
Sulfuro de arsénico (III)
Orpiment |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| Tarjeta de información ECHA |
100.013.744 |
| Número CE | |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| Como 2 S 3 | |
| Masa molar | 246,02 g · mol −1 |
| Apariencia | Cristales naranjas |
| Densidad | 3,43 g cm −3 |
| Punto de fusion | 310 ° C (590 ° F; 583 K) |
| Punto de ebullición | 707 ° C (1.305 ° F; 980 K) |
| -70,0 · 10 −6 cm 3 / mol | |
| Estructura | |
| P2 1 / n (No. 11) | |
|
a = 1147.5 (5) pm, b = 957.7 (4) pm, c = 425.6 (2) pm
α = 90 °, β = 90,68 (8) °, γ = 90 °
|
|
| piramidal (As) | |
| Riesgos | |
| Pictogramas GHS |
 
|
| Palabra de señal GHS | Peligro |
| H300 , H331 , H400 , H411 | |
| NFPA 704 (diamante de fuego) | |
| NIOSH (límites de exposición a la salud de EE. UU.): | |
|
PEL (permitido)
|
[1910.1018] TWA 0.010 mg / m 3 |
|
REL (recomendado)
|
Ca C 0,002 mg / m 3 [15 minutos] |
|
IDLH (peligro inmediato)
|
Ca [5 mg / m 3 (como As)] |
| Compuestos relacionados | |
|
Otros aniones
|
Trióxido de arsénico Triselenuro de arsénico Telururo de arsénico |
|
Otros cationes
|
Trisulfuro de fósforo Trisulfuro de antimonio Sulfuro de bismuto |
|
Compuestos relacionados
|
Tetrasulfuro tetraarsénico |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
El trisulfuro de arsénico es el compuesto inorgánico de fórmula As 2 S 3 . Es un sólido de color amarillo oscuro que es insoluble en agua. También se presenta como el mineral orpiment (latín: auripigment), que se ha utilizado como un pigmento llamado King's Yellow. Se produce en el análisis de compuestos de arsénico. Es un semiconductor intrínseco de tipo p del grupo V / VI y exhibe propiedades de cambio de fase fotoinducidas. El otro sulfuro de arsénico principal es As 4 S 4 , un sólido rojo anaranjado conocido como mineral realgar .
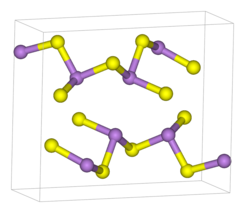
Estructura
Como 2 S 3 se presenta tanto en forma cristalina como amorfa. Ambas formas presentan estructuras poliméricas que consisten en centros de As (III) piramidales trigonales unidos por centros de sulfuro. Los centros de sulfuro están coordinados en dos partes con dos átomos de arsénico. En forma cristalina, el compuesto adopta una estructura de hoja ondulada. La unión entre las hojas consiste en fuerzas de van der Waals . La forma cristalina se encuentra generalmente en muestras geológicas. Amorfo As 2 S 3 no posee una estructura en capas pero está más altamente reticulado. Como otras gafas, no existe un orden de mediano o largo alcance, pero la primera esfera de coordinación está bien definida. Como 2 S 3 es un buen formador de vidrio y presenta una amplia región de formación de vidrio en su diagrama de fase.
Propiedades
Es un semiconductor , con una banda prohibida directa de 2,7 eV. El ancho de banda prohibida lo hace transparente al infrarrojo entre 620 nm y 11 µm.
Síntesis
De los elementos
El As 2 S 3 amorfo se obtiene mediante la fusión de los elementos a 390 ° C. El enfriamiento rápido de la masa fundida de reacción produce un vidrio. La reacción se puede representar con la ecuación química:
- 2 Como + 3 S → Como 2 S 3
Precipitación acuosa
Se forma As 2 S 3 cuando se tratan soluciones acuosas que contienen As (III) con H 2 S. El arsénico se analizó y ensayó en el pasado mediante esta reacción, lo que da como resultado la precipitación de As 2 S 3 , que luego se pesa. Como 2 S 3 puede incluso precipitarse en HCl 6M. Como 2 S 3 es tan insoluble que no es tóxico.
Reacciones
Al calentar al vacío, el As 2 S 3 polimérico se "agrieta" para dar una mezcla de especies moleculares, incluido el As 4 S 6 molecular . As 4 S 6 adopta la geometría adamantano , como la observada para P 4 O 6 y As 4 O 6 . Cuando una película de este material se expone a una fuente de energía externa, como energía térmica (mediante recocido térmico), radiación electromagnética (es decir, lámparas UV, láseres, haces de electrones), As 4 S 6 polimeriza:
- 2 / n (Como 2 S 3 ) n ⇌ Como 4 S 6
Como 2 S 3 se disuelve característicamente tras el tratamiento con soluciones acuosas que contienen iones sulfuro . La especie de arsénico disuelto es el trianión piramidal AsS3−
3:
- Como 2 S 3 + 6 NaSH → 2 ComoS3−
3 + 3 H 2 S
As 2 S 3 es el anhídrido del hipotético ácido tioarsenoso, As (SH) 3 . Tras el tratamiento con iones polisulfuro , As 2 S 3 se disuelve para dar una variedad de especies que contienen enlaces SS y As-S. Un derivado es S 7 As-S - , un anillo que contiene un centro sulfido exocíclico unido al átomo de As. As 2 S 3 también se disuelve en soluciones fuertemente alcalinas para dar una mezcla de AsS3−
3y AsO3−
3.
"Tostado" Como 2 S 3 en el aire produce derivados tóxicos volátiles, esta conversión es uno de los peligros asociados con el refinado de minerales de metales pesados :
- 2 Como 2 S 3 + 9 O 2 → Como 4 O 6 + 6 SO 2
Usos contemporáneos
Como fotorresistente inorgánico
Debido a su alto índice de refracción de 2,45 y su gran dureza Knoop en comparación con las fotorresistencias orgánicas , As 2 S 3 se ha investigado para la fabricación de cristales fotónicos con un intervalo de banda fotónico completo. Los avances en las técnicas de creación de patrones láser, como la escritura láser directa tridimensional (3-D DLW) y la química química de grabado en húmedo , han permitido que este material se utilice como fotorresistente para fabricar nanoestructuras 3-D.
As 2 S 3 se ha investigado para su uso como material fotorresistente de alta resolución desde principios de la década de 1970, utilizando agentes decapantes acuosos. Aunque estos agentes de grabado acuosos permitieron la fabricación de estructuras 2-D de relación de aspecto baja, no permiten el grabado de estructuras de relación de aspecto alta con periodicidad 3-D. Ciertos reactivos orgánicos, usados en solventes orgánicos, permiten la alta selectividad de grabado requerida para producir estructuras de alta relación de aspecto con periodicidad 3-D.
Aplicaciones médicas
As 2 S 3 y As 4 S 4 se han investigado como tratamientos para la leucemia promielocítica aguda (APL).
Para gafas con transmisión de infrarrojos
El trisulfuro de arsénico fabricado en forma amorfa se utiliza como vidrio de calcogenuro para óptica infrarroja . Es transparente entre 620 nm y 11 µm. El vidrio de trisulfuro de arsénico es más resistente a la oxidación que el trisulfuro de arsénico cristalino, lo que minimiza los problemas de toxicidad. También se puede utilizar como material acústico-óptico .
Se utilizó trisulfuro de arsénico para la distintiva nariz cónica de ocho lados sobre el buscador de infrarrojos del misil de Havilland Firestreak .
Papel en el arte antiguo
Según los informes, los antiguos egipcios usaban oropimento, natural o sintético, como pigmento en el arte y la cosmética.
Diverso
El trisulfuro de arsénico también se usa como agente curtiente . Anteriormente se usaba con tinte índigo para la producción de azul lápiz, lo que permitía agregar tonos azul oscuro a la tela a través de un lápiz o un pincel.
La precipitación de trisulfuro de arsénico se utiliza como prueba analítica para detectar la presencia de bacterias disimilatorias reductoras de arsénico (DARB).
La seguridad
Como 2 S 3 es tan insoluble que su toxicidad es baja. Las muestras envejecidas pueden contener cantidades sustanciales de óxidos de arsénico, que son solubles y, por lo tanto, altamente tóxicos.
Ocurrencia natural
El oropimente se encuentra en ambientes volcánicos, a menudo junto con otros sulfuros de arsénico, principalmente realgar . A veces se encuentra en vetas hidrotermales de baja temperatura, junto con algunos otros minerales de sulfuro y sulfosal.
Referencias
Otras lecturas
- "El arsénico y compuestos de arsénico", En general, las evaluaciones de la carcinogenicidad: una actualización de la IARC Monografías Volúmenes 1 a 42 (PDF) , CIIC Monografías sobre la evaluación de carcinogénico riesgos para las personas Suplemento 7, Lyon, Francia: Agencia Internacional para la Investigación sobre el Cáncer, 1987 , págs. 100–6, ISBN 92-832-1411-0. "Arsénico en el agua potable", Algunos desinfectantes y contaminantes del agua potable, incluido el arsénico (PDF) , IARC Monographs on the Evaluation of Carcinogenic Risks to Humans 84, Lyon, Francia: Agencia Internacional para la Investigación del Cáncer, 2004, págs. 39– 267, ISBN 92-832-1284-3.
- "Compuestos de arsénico, inorgánicos", Informe sobre carcinógenos, undécima edición (PDF), Departamento de Salud y Servicios Humanos de EE. UU., Servicio de Salud Pública, Programa Nacional de Toxicología, 2005.

