Pentóxido de arsénico - Arsenic pentoxide

|
|
| Nombres | |
|---|---|
| Otros nombres
Óxido de arsénico (V)
Óxido de arsénico Anhídrido de arsénico |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| Tarjeta de información ECHA |
100.013.743 |
| Número CE | |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
| un numero | 1559 |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| Como 2 O 5 | |
| Masa molar | 229,8402 g / mol |
| Apariencia | polvo higroscópico blanco |
| Densidad | 4,32 g / cm 3 |
| Punto de fusion | 315 ° C (599 ° F; 588 K) (se descompone) |
| 59,5 g / 100 ml (0 ° C) 65,8 g / 100 ml (20 ° C) 8,20 g / 100 ml (100 ° C) |
|
| Solubilidad | soluble en alcohol |
| Acidez (p K a ) | 7 |
| Peligros | |
| Pictogramas GHS |
  
|
| Palabra de señal GHS | Peligro |
| H301 , H331 , H350 , H400 , H410 | |
| P201 , P202 , P261 , P264 , P270 , P271 , P273 , P281 , P301 + 310 , P304 + 340 , P308 + 313 , P311 , P321 , P330 , P391 , P403 + 233 , P405 , P501 | |
| NFPA 704 (diamante de fuego) | |
| Dosis o concentración letal (LD, LC): | |
|
LD 50 ( dosis mediana )
|
8 mg / kg (rata, oral) |
| NIOSH (límites de exposición a la salud de EE. UU.): | |
|
PEL (permitido)
|
[1910.1018] TWA 0.010 mg / m 3 |
|
REL (recomendado)
|
Ca C 0,002 mg / m 3 [15 minutos] |
|
IDLH (peligro inmediato)
|
Ca [5 mg / m 3 (como As)] |
| Compuestos relacionados | |
|
Otros cationes
|
Pentóxido de fósforo Pentóxido de antimonio |
|
Compuestos relacionados
|
Trióxido de arsénico Ácido arsénico |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
El pentóxido de arsénico es el compuesto inorgánico de fórmula As 2 O 5 . Este sólido delicuescente , blanco y vítreo es relativamente inestable, de acuerdo con la rareza del estado de oxidación del As (V). Más común, y mucho más importante comercialmente, es el óxido de arsénico (III) (As 2 O 3 ). Todos los compuestos de arsénico son altamente tóxicos y, por lo tanto, solo encuentran aplicaciones comerciales limitadas.
Estructura
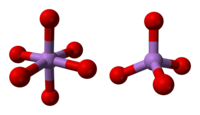
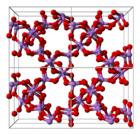
La estructura consta de centros tetraédricos {AsO 4 } y octaédricos {AsO 6 } unidos por esquinas compartidas. La estructura difiere de la del correspondiente óxido de fósforo (V) ; como resultado, aunque todavía hay una solución sólida con ese óxido, solo progresa hasta el punto equimolar, momento en el que el fósforo ha sustituido al arsénico en todos sus sitios tetraédricos. Asimismo, el pentóxido de arsénico también puede disolver hasta una cantidad equimolar de pentóxido de antimonio , ya que el antimonio sustituye al arsénico solo en sus sitios octaédricos.
 |
 |
|
| Como coordinacion | celda unitaria | embalaje celular |
Síntesis
Histórico
Paracelsus Macquer encontró una sal cristalizable a la que llamó "sel neutre arsenical". Esta sal fue el residuo obtenido después de destilar ácido nítrico a partir de una mezcla de nitrato de potasio y trióxido de arsénico . Previamente, Paracelso calentó una mezcla de trióxido de arsénico y nitrato de potasio. Aplicó el término 'arsenicum fixum' al producto. A. Libavius llamó al mismo producto 'butyrum arsenici' (mantequilla de arsénico), aunque este término se usó en realidad para el tricloruro de arsénico. Los productos que encontraron Paracelso y Libavio eran todos arseniatos alcalinos impuros. Scheele preparó varios arseniatos mediante la acción del ácido arsénico sobre los álcalis. Uno de los arseniatos que preparó fue el pentóxido de arsénico. El agua de los álcalis se evaporó a 180 ° C y el pentóxido de arsénico se mantuvo estable por debajo de 400 ° C.
Métodos modernos
El pentóxido de arsénico se puede cristalizar calentando As 2 O 3 bajo oxígeno. Esta reacción es reversible:
- Como 2 O 5 ⇌ Como 2 O 3 + O 2
Los agentes oxidantes fuertes como el ozono , el peróxido de hidrógeno y el ácido nítrico convierten el trióxido de arsénico en pentóxido.
El ácido arsénico se puede generar mediante el procesamiento rutinario de compuestos de arsénico, incluida la oxidación de arsénico y minerales que contienen arsénico en el aire. Ilustrativo es el tostado de oropimente , un mineral típico de sulfuro de arsénico:
- 2 Como 2 S 3 + 11 O 2 → 2 Como 2 O 5 + 6 SO 2
Seguridad
Como todos los compuestos de arsénico, el pentóxido es muy tóxico. Su arsenito derivado reducido, que es un compuesto de As (III), es aún más tóxico ya que tiene una alta afinidad por los grupos tiol de los residuos de cisteína en las proteínas.
Está clasificada como una sustancia extremadamente peligrosa en los Estados Unidos según se define en la Sección 302 de la Ley de Planificación de Emergencias y Derecho a la Información de la Comunidad de EE. UU. (42 USC 11002), y está sujeta a estrictos requisitos de notificación por parte de las instalaciones que producen, almacenan, o utilícelo en cantidades significativas.
Referencias
- ^ a b c Guía de bolsillo de NIOSH sobre peligros químicos. "# 0038" . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Greenwood, Norman N .; Earnshaw, Alan (1997). Química de los Elementos (2ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ↑ a b Martin Jansen (1977). "Estructura cristalina de As 2 O 5 ". Angewandte Chemie International Edition en inglés . 16 (5): 314–315. doi : 10.1002 / anie.197703142 .
- ^ Greenwood, Norman N .; Earnshaw, Alan (1997). Química de los Elementos (2ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ a b J. W. Mellor. "Tratado integral de química inorgánica y teórica" . Archivado desde el original el 11 de mayo de 2012 . Consultado el 30 de marzo de 2013 .
- ^ CW Zenger; et al. "Arsénico 149" . Archivado desde el original el 9 de abril de 2013.
- ^ Grund, SC; Hanusch, K .; Wolf, HU "Arsénico y compuestos de arsénico". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a03_113.pub2 .
-
^ "40 CFR: Apéndice A de la parte 355: la lista de sustancias extremadamente peligrosas y sus cantidades de planificación de umbral" (PDF) (1 de julio de 2008 ed.). Oficina de Imprenta del Gobierno . Archivado desde el original (PDF) el 25 de febrero de 2012 . Consultado el 29 de octubre de 2011 . Cite journal requiere
|journal=( ayuda )
enlaces externos
- Guía de bolsillo de NIOSH sobre peligros químicos
- Monografía de la IARC - Arsénico y compuestos de arsénico
- Informe NTP sobre carcinógenos: compuestos inorgánicos de arsénico
- ESIS: Sistema europeo de información sobre sustancias químicas
- Linstrom, Peter J .; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov

