Número cuántico azimutal - Azimuthal quantum number

| Parte de una serie de artículos sobre |
| Mecánica cuántica |
|---|
El número cuántico azimutal es un número cuántico para un orbital atómico que determina su momento angular orbital y describe la forma del orbital. El número cuántico azimutal es el segundo de un conjunto de números cuánticos que describen el estado cuántico único de un electrón (los otros son el número cuántico principal , el número cuántico magnético y el número cuántico de espín ). También se conoce como número cuántico de momento angular orbital , número cuántico orbital o segundo número cuántico , y se simboliza como ℓ (pronunciado ell ).
Derivación
Conectados con los estados de energía de los electrones del átomo hay cuatro números cuánticos: n , ℓ , m ℓ y m s . Estos especifican el estado cuántico completo y único de un solo electrón en un átomo y forman su función de onda u orbital . Al resolver para obtener la función de onda, la ecuación de Schrödinger se reduce a tres ecuaciones que conducen a los primeros tres números cuánticos. Por lo tanto, las ecuaciones de los tres primeros números cuánticos están todas interrelacionadas. El número cuántico azimutal surgió en la solución de la parte polar de la ecuación de onda como se muestra a continuación, dependiendo del sistema de coordenadas esféricas , que generalmente funciona mejor con modelos que tienen algún atisbo de simetría esférica .
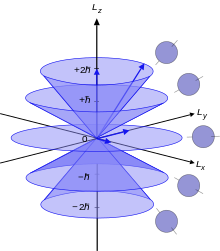
El momento angular de un electrón atómico , L , está relacionado con su número cuántico ℓ mediante la siguiente ecuación:
donde ħ es la constante de Planck reducida , L 2 es el operador del momento angular orbital y es la función de onda del electrón. El número cuántico ℓ es siempre un entero no negativo: 0, 1, 2, 3, etc. L no tiene un significado real excepto en su uso como operador de momento angular . Cuando se refiere al momento angular, es mejor simplemente usar el número cuántico ℓ .
Los orbitales atómicos tienen formas distintivas indicadas por letras. En la ilustración, las letras s , p , y d (una convención originarios de espectroscopia ) describen la forma del orbital atómica .
Sus funciones de onda toman la forma de armónicos esféricos , por lo que se describen en los polinomios de Legendre . Los diversos orbitales relacionados con diferentes valores de ℓ a veces se denominan subcapas , y se denominan letras latinas minúsculas (elegidas por razones históricas), de la siguiente manera:
Subcapas cuánticas para el número cuántico azimutal
Número azimutal ( ℓ )
Carta histórica
Electrones máximos
Nombre historicoForma 0 s 2 s arpa esférico 1 pag 6 p rincipal tres orbitales alineados polares en forma de mancuerna ; un lóbulo en cada polo de los ejes x, y y z (+ y - ejes) 2 D 10 d iffuse nueve mancuernas y una rosquilla (o "forma única n. ° 1", vea esta imagen de armónicos esféricos, tercera fila en el centro ) 3 F 14 f undamental "Forma única n. ° 2" (vea esta imagen de armónicos esféricos, centro de la fila inferior ) 4 gramo 18 5 h 22 6 I 26 Las letras después de la sub-capa f simplemente siguen a la letra f en orden alfabético, excepto la letra j y las ya utilizadas.
Cada uno de los diferentes estados de momento angular puede tomar 2 (2 ℓ + 1) electrones. Esto se debe a que el tercer número cuántico m ℓ (que puede considerarse vagamente como la proyección cuantificada del vector de momento angular en el eje z) va de - ℓ a ℓ en unidades enteras, por lo que hay 2 ℓ + 1 posibles estados. Cada orbital n , ℓ , m ℓ distinto puede estar ocupado por dos electrones con espines opuestos (dado por el número cuántico m s = ± ½), dando 2 (2 ℓ + 1) electrones en total. Los orbitales con ℓ más alto que los dados en la tabla son perfectamente permisibles, pero estos valores cubren todos los átomos descubiertos hasta ahora.
Para un valor dado del número cuántico principal n , los posibles valores de ℓ van de 0 a n - 1; por lo tanto, la capa n = 1 solo posee una subcapa s y solo puede tomar 2 electrones, la capa n = 2 posee una subcapa s y una p y puede tomar 8 electrones en total, la capa n = 3 posee s , p y d subcapas y tiene un máximo de 18 electrones, y así sucesivamente.
Un modelo simplista de un electrón da como resultado niveles de energía que dependen solo del número principal. En átomos más complejos, estos niveles de energía se dividen para todo n > 1, colocando los estados de mayor ℓ por encima de los estados de menor ℓ . Por ejemplo, la energía de 2p es mayor que la de 2s, 3d ocurre por encima de 3p, que a su vez está por encima de 3s, etc. Este efecto eventualmente forma la estructura de bloques de la tabla periódica. Ningún átomo conocido posee un electrón que tenga ℓ superior a tres ( f ) en su estado fundamental .
El número cuántico de momento angular, ℓ , gobierna el número de nodos planos que atraviesan el núcleo. Un nodo plano se puede describir en una onda electromagnética como el punto medio entre la cresta y el valle, que tiene magnitudes cero. En un orbital s, ningún nodo atraviesa el núcleo, por lo tanto, el número cuántico azimutal correspondiente ℓ toma el valor de 0. En un orbital p , un nodo atraviesa el núcleo y, por lo tanto, ℓ tiene el valor de 1. tiene el valor .
Dependiendo del valor de n , existe un número cuántico de momento angular ℓ y la siguiente serie. Las longitudes de onda enumeradas son para un átomo de hidrógeno :
- , Serie Lyman (ultravioleta)
- , Serie Balmer (visible)
- , Serie Ritz-Paschen ( infrarrojo cercano )
- , Serie Brackett ( infrarrojos de onda corta )
- , Serie Pfund ( infrarrojos de longitud de onda media ).
Adición de momentos angulares cuantificados
Dado un momento angular total cuantificado que es la suma de dos momentos angulares cuantificados individuales y ,
el número cuántico asociado con su magnitud puede variar de a en pasos enteros donde y son números cuánticos correspondientes a las magnitudes de los momentos angulares individuales.
Momento angular total de un electrón en el átomo

Debido a la interacción espín-órbita en el átomo, el momento angular orbital ya no conmuta con el hamiltoniano , ni tampoco el espín . Por tanto, estos cambian con el tiempo. Sin embargo, el momento angular total J conmuta con el hamiltoniano de un electrón y, por lo tanto, es constante. J se define mediante
L es el momento angular orbital y S el giro. El momento angular total satisface las mismas relaciones de conmutación que el momento angular orbital , a saber
de lo que sigue
donde J i representa J x , J y y J z .
Los números cuánticos que describen el sistema, que son constantes en el tiempo, ahora son j y m j , definidos a través de la acción de J sobre la función de onda.
De modo que j está relacionado con la norma del momento angular total y m j con su proyección a lo largo de un eje especificado. El número j tiene una importancia particular para la química cuántica relativista , a menudo aparece en un subíndice en la configuración electrónica de elementos superpesados .
Al igual que con cualquier momento angular en la mecánica cuántica , la proyección de J a lo largo de otros ejes no se puede co-definir con J z , porque no se conmutan.
Relación entre números cuánticos nuevos y antiguos
j y m j , junto con la paridad del estado cuántico , reemplazan el tres números cuánticos ℓ , m ℓ y m s (la proyección de la rotación a lo largo del eje especificado). Los primeros números cuánticos pueden relacionarse con los últimos.
Además, los autovectores de j , s , m j y la paridad, que también son autovectores del hamiltoniano , son combinaciones lineales de los autovectores de ℓ , s , m ℓ y m s .
Lista de números cuánticos de momento angular
- Número cuántico de momento angular intrínseco (o de espín), o simplemente número cuántico de espín
- número cuántico de momento angular orbital (el tema de este artículo)
- número cuántico magnético , relacionado con el número cuántico del momento orbital
- número cuántico de momento angular total
Historia
El número cuántico azimutal se transfirió del modelo de Bohr del átomo y fue propuesto por Arnold Sommerfeld . El modelo de Bohr se derivó del análisis espectroscópico del átomo en combinación con el modelo atómico de Rutherford . Se encontró que el nivel cuántico más bajo tenía un momento angular de cero. Las órbitas con momento angular cero se consideraron cargas oscilantes en una dimensión y, por lo tanto, se describieron como órbitas de "péndulo", pero no se encontraron en la naturaleza. En tres dimensiones, las órbitas se vuelven esféricas sin ningún nodo que cruce el núcleo, similar (en el estado de menor energía) a una cuerda de saltar que oscila en un gran círculo.
Ver también
- Operador de momento angular
- Introducción a la mecánica cuántica
- Partícula en un potencial esférico simétrico
- Acoplamiento de momento angular
- Coeficientes de Clebsch-Gordan
Referencias
- ^ Eisberg, Robert (1974). Física cuántica de átomos, moléculas, sólidos, núcleos y partículas . Nueva York: John Wiley & Sons Inc. págs. 114-117. ISBN 978-0-471-23464-7.
- ^ RB Lindsay (1927). "Nota sobre las órbitas de" péndulo "en modelos atómicos" . Proc. Natl. Acad. Sci . 13 (6): 413–419. Código Bibliográfico : 1927PNAS ... 13..413L . doi : 10.1073 / pnas.13.6.413 . PMC 1085028 . PMID 16587189 .





















![[J_i, J_j] = i \ hbar \ epsilon_ {ijk} J_k](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c774fd99fb91eb8937cbaaa6b6af2eaf88e7ad6)
![\ left [J_i, J ^ 2 \ right] = 0](https://wikimedia.org/api/rest_v1/media/math/render/svg/df773fc4aa955999fbf21070fb2d56ae4252b0ef)

