Hexacloroiridato de amonio (IV) - Ammonium hexachloroiridate(IV)
|
|

|
|
| Identificadores | |
|---|---|
|
Modelo 3D ( JSmol )
|
|
| CHEBI | |
| ChemSpider | |
| Tarjeta de información ECHA |
100.037.264 |
| Número CE | |
|
PubChem CID
|
|
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| H 8 N 2 Cl 6 Ir | |
| Masa molar | 441.01 |
| Apariencia | cristales marrones |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
| Referencias de Infobox | |
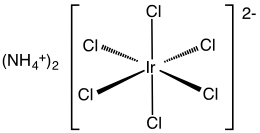
El hexacloroiridato de amonio (IV) es el compuesto inorgánico de fórmula (NH 4 ) 2 [IrCl 6 ]. Este sólido marrón oscuro es la sal de amonio del complejo de iridio (IV) [IrCl 6 ] 2− . Es un compuesto de iridio de importancia comercial, uno de los complejos más comunes de iridio (IV). Un compuesto relacionado pero mal definido es el tetracloruro de iridio , que a menudo se usa indistintamente.
Estructura
El compuesto se ha caracterizado por cristalografía de rayos X . La sal cristaliza en un motivo cúbico como el del hexacloroplatinato de amonio . Los centros [IrCl 6 ] 2− adoptan una geometría molecular octaédrica .
Usos
Es un intermedio clave en el aislamiento de iridio de minerales. La mayoría de los otros metales forman sulfuros insolubles cuando las soluciones acuosas de sus cloruros se tratan con sulfuro de hidrógeno , pero el [IrCl 6 ] 2 - resiste la sustitución del ligando. Al calentar bajo hidrógeno, la sal sólida se convierte en metal:
- (NH 4 ) 2 [IrCl 6 ] + 2 H 2 → Ir + 6 HCl + 2 NH 3
Vinculación
La estructura electrónica del hexacloroiridato de amonio (IV) ha atraído mucha atención. Su momento magnético es menor que el calculado para un electrón. Este resultado se interpreta como el resultado del acoplamiento antiferromagnético entre los centros de Ir mediado por interacciones Cl-Cl. Los estudios de resonancia de espín electrónico revelan que más de la mitad de la densidad de espín reside en el cloruro, por lo que la descripción del complejo como Ir (IV) es una simplificación excesiva.
