Radical amino - Amino radical
|
|
|||
| Nombres | |||
|---|---|---|---|
|
Nombre IUPAC sistemático
Azanil (sustitutivo) Dihidridonitrógeno (•) (aditivo) |
|||
| Otros nombres
Amidógeno; Radical aminilo; Radical azanilo
|
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| CHEBI | |||
| ChemSpider | |||
|
PubChem CID
|
|||
|
|||
|
|||
| Propiedades | |||
|
NUEVA HAMPSHIRE 2• |
|||
| Masa molar | 16.0226 g mol −1 | ||
| Termoquímica | |||
|
Entropía molar estándar ( S |
194,71 JK −1 mol −1 | ||
| 190,37 kJ mol −1 | |||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencias de Infobox | |||
El radical amino ,•
NUEVA HAMPSHIRE
2, también conocido como radical aminilo o radical azanilo , es la forma neutra del ion amida ( NH-
2). Los aminilo son muy reactivos y, en consecuencia, de corta duración como la mayoría de los radicales ; sin embargo, forman una parte importante de la química del nitrógeno. En una concentración suficientemente alta, los radicales amino se dimerizan para formar hidrazina . Si bien el NH 2 como grupo funcional es común en la naturaleza y forma parte de muchos compuestos (por ejemplo, las fenetilaminas ), el radical no puede aislarse en su forma libre.
Síntesis
Reacción 1: Formación de un radical amino a partir de amoníaco.
Los radicales amino se pueden producir haciendo reaccionar el radical OH con amoniaco en soluciones acuosas irradiadas. Esta reacción se formula como una reacción de abstracción de hidrógeno.
- NH 3 + • OH → • NH 2 + H 2 O
Se determinó que la constante de velocidad ( k 1 ) para esta reacción era1.0 × 10 8 M −1 s −1 , mientras que la reacción paralela de OH con NH+
4se encontró que era mucho más lento. Esta tasa se volvió a determinar mediante el uso de métodos de competición por radiolisis de dos pulsos con iones benzoato y tiocianato a pH 11,4. Se obtuvo un valor de k 1 = (9 + 1) × 10 7 M −1 s −1 de ambos sistemas. Mientras está en solución ácida, la reacción correspondiente de • OH con NH+
4 es demasiado lento para ser observado por radiólisis de pulsos.
Reacción 2: Formación de un radical amino a partir de hidroxilamina.
El radical amino también se puede producir por reacción de e - (aq) con hidroxilamina (NH 2 OH) . Varios estudios también utilizaron el sistema redox de Ti III -NH 2 OH para la producción de radicales amino usando espectroscopía de resonancia paramagnética electrónica (ESR) y polarografía.
- Ti III + NH 2 OH → Ti IV + • NH 2 + OH -
Reacción 3: Formación de un radical amino a partir de amonioilo.
También se ha sugerido que la reducción de hidroxilamina por e - (aq) produce el radical amino en la siguiente reacción.
-
• NH+
3⇌ • NH 2 + H +
Se espera que la reactividad del radical amino en esta reacción sea dependiente del pH y debería ocurrir en la región de pH 3-7.
Propiedades
Estados electrónicos
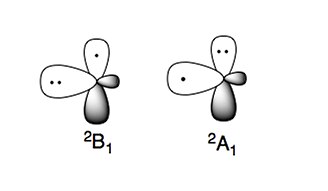
El radical amino tiene dos estados electrónicos característicos:
El estado electrónico más estable es 2 B 1 , donde el electrón desapareado está en el orbital p perpendicular al plano de la molécula (radical tipo π). El estado electrónico de alta energía, 2 A 1 , tiene los dos electrones en el orbital p y el electrón no apareado en el orbital sp 2 (radical tipo σ).
Los compuestos centrados en nitrógeno, como las aminas, son de naturaleza nucleofílica . Este carácter también se observa en los radicales amino, que pueden considerarse especies nucleofílicas.
Propiedades espectrales
El radical amino solo exhibe una absorción óptica muy baja en la región visible ( λ max = 530 nm, ε max = 81 M −1 s −1 ), mientras que su absorción en el UV (<260 nm) es similar a la del OH . Debido a esto, no es práctico determinar la velocidad de reacción del radical amino con compuestos orgánicos siguiendo la desintegración del radical amino.
Reactividad
En general, los radicales amino son muy reactivos y de corta duración; sin embargo, este no es el caso cuando reacciona con algunas moléculas orgánicas. Se han informado reactividades relativas del radical amino con varios compuestos orgánicos, pero se desconocen las constantes de velocidad absoluta para tales reacciones. En la reacción 1, se planteó la hipótesis de que el radical amino posiblemente podría reaccionar con el NH 3 más rápidamente que el OH y podría oxidar el NH.+
4para producir el radical amino en soluciones ácidas, dado que los radicales son oxidantes más fuertes que el OH. Para probar esto, se utilizaron aniones radicales sulfato y fosfato . Se encontró que los aniones de los radicales sulfato y fosfato reaccionan más lentamente con el NH 3 que el radical amino y reaccionan con el amoníaco por abstracción de hidrógeno y no por oxidación por transferencia de electrones.
Cuando el radical amino reacciona con iones benzoato , la constante de velocidad es muy baja y solo se observa una absorción débil en el espectro UV, lo que indica que los radicales amino no reaccionan con el benceno rápidamente. Por otro lado, se encontró que el fenol reaccionaba más rápidamente con el radical amino. En experimentos a pH 11,3 y 12, usando NH 3 1,5 M y concentraciones variables de fenol entre 4 y 10 mM, se observó la formación del radical fenoxilo de absorción con una constante de velocidad de (3 + 0,4) × 10 6 M −1 s −1 . Esta reacción puede producir radicales fenoxilo a través de dos posibles mecanismos:
- Adición al anillo seguida de eliminación de NH 3 , o
- Oxidación por transferencia directa de electrones.

Si bien se sabe que el radical amino es débilmente reactivo, el proceso de recombinación de dos radicales amino para formar hidrazina parece ser uno de los más rápidos. Como resultado, a menudo compite con otras reacciones de NH 2 .
- NH 2 + NH 2 → N 2 H 4
A presiones bajas, esta reacción es la más rápida y, por lo tanto, el modo principal de desaparición del NH 2 .
Ver también
- Amida
- Amina
- Radical (química)
- Hidrazina (dímero)
Referencias
Otras lecturas
- Davies, P (2008). "Detección del radical amino NH 2 por espectroscopia de resonancia magnética láser". La Revista de Física Química . 62 (9): 3739. doi : 10.1063 / 1.430970 .
- Buttner, T (2005). "Un complejo metálico de radical aminilo estable". Ciencia . 307 (5707): 235–8. Código Bibliográfico : 2005Sci ... 307..235B . doi : 10.1126 / science.1106070 . PMID 15653498 .
- John, Seely (1977). "Dependencia de la temperatura y la presión de la constante de velocidad para la reacción de HO 2 + NO". La Revista de Química Física . 81 (10): 210–214. doi : 10.1021 / jp952553f .
- Koenig, Hoobler (1974). "Configuraciones electrónicas de radicales amino". Revista de la Sociedad Química Estadounidense . 96 (14): 4573–4577. doi : 10.1021 / ja00821a036 .