Adenosina desaminasa - Adenosine deaminase
| Adenosina / AMP desaminasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
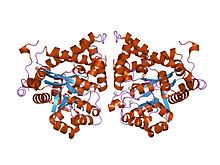 estructura cristalina de plasmodium yoelii adenosina desaminasa (py02076)
| |||||||||
| Identificadores | |||||||||
| Símbolo | A_deaminase | ||||||||
| Pfam | PF00962 | ||||||||
| Clan pfam | CL0034 | ||||||||
| InterPro | IPR001365 | ||||||||
| PROSITE | PDOC00419 | ||||||||
| SCOP2 | 1add / SCOPe / SUPFAM | ||||||||
| CDD | cd01320 | ||||||||
| |||||||||
| Dominio de adenosina desaminasa (editasa) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | A_deamin | ||||||||
| Pfam | PF02137 | ||||||||
| InterPro | IPR002466 | ||||||||
| PROSITE | PDOC00419 | ||||||||
| SCOP2 | 1add / SCOPe / SUPFAM | ||||||||
| |||||||||
| Adenosina / AMP desaminasa N-terminal | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | A_deaminase_N | ||||||||
| Pfam | PF08451 | ||||||||
| InterPro | IPR013659 | ||||||||
| |||||||||
La adenosina desaminasa (también conocida como adenosina aminohidrolasa o ADA ) es una enzima ( EC 3.5.4.4 ) involucrada en el metabolismo de las purinas . Es necesario para la descomposición de la adenosina de los alimentos y para el recambio de ácidos nucleicos en los tejidos.
Su función principal en los seres humanos es el desarrollo y mantenimiento del sistema inmunológico. Sin embargo, el papel fisiológico completo de la ADA aún no se comprende completamente.
Estructura
El ADA existe tanto en forma pequeña (como monómero) como en forma grande (como complejo dímero). En la forma de monómero, la enzima es una cadena polipeptídica, plegada en ocho hebras de barriles α / β paralelos, que rodean un bolsillo central profundo que es el sitio activo. Además de los ocho barriles β centrales y las ocho hélices α periféricas , ADA también contiene cinco hélices adicionales: residuos 19-76 veces en tres hélices, ubicados entre los pliegues β1 y α1; y dos hélices carboxi-terminales antiparalelas están ubicadas a través del terminal amino del barril β.
El sitio activo de ADA contiene un ion zinc, que se encuentra en el receso más profundo del sitio activo y está coordinado por cinco átomos de His15, His17, His214, Asp295 y el sustrato. El zinc es el único cofactor necesario para la actividad.
El sustrato, la adenosina, se estabiliza y se une al sitio activo mediante nueve enlaces de hidrógeno. El grupo carboxilo de Glu217, aproximadamente coplanar con el anillo de purina del sustrato, está en posición de formar un enlace de hidrógeno con el N1 del sustrato. El grupo carboxilo de Asp296, también coplanar con el anillo de purina del sustrato, forma un enlace de hidrógeno con el N7 del sustrato. El grupo NH de Gly184 está en posición de formar un enlace de hidrógeno con el N3 del sustrato. Asp296 forma enlaces tanto con el ion Zn 2+ como con el 6-OH del sustrato. His238 también tiene enlaces de hidrógeno con el sustrato 6-OH. El 3'-OH del sustrato ribosa forma un enlace de hidrógeno con Asp19, mientras que el 5'-OH forma un enlace de hidrógeno con His17. Se forman otros dos enlaces de hidrógeno a las moléculas de agua, en la apertura del sitio activo, por el 2'-OH y 3'-OH del sustrato.
Debido al receso del sitio activo dentro de la enzima, el sustrato, una vez unido, es casi completamente secuestrado del solvente. La exposición de la superficie del sustrato al disolvente cuando está unido es del 0,5% de la exposición de la superficie del sustrato en estado libre.
Reacciones
ADA desamina irreversiblemente la adenosina, convirtiéndola en el nucleósido inosina relacionado mediante la sustitución del grupo amino por un grupo ceto.
Luego, la inosina puede deribosilarse (eliminarse de la ribosa ) por otra enzima llamada purina nucleósido fosforilasa (PNP), convirtiéndola en hipoxantina .
Mecanismo de catálisis
El mecanismo propuesto para la desaminación catalizada por ADA es la adición-eliminación estereoespecífica mediante un intermedio tetraédrico. Por cualquier mecanismo, el Zn 2+ como un electrófilo fuerte activa una molécula de agua, que es desprotonada por el Asp295 básico para formar el hidróxido atacante. His238 orienta la molécula de agua y estabiliza la carga del hidróxido atacante. Glu217 se protona para donar un protón al N1 del sustrato.
La reacción es estereoespecífica debido a la ubicación de los residuos de zinc, Asp295 e His238, que miran hacia el lado B del anillo de purina del sustrato.
Se ha observado inhibición competitiva para ADA, donde el producto inosina actúa como inhibidor competitivo de la actividad enzimática.
Función
La ADA se considera una de las enzimas clave del metabolismo de las purinas. La enzima se ha encontrado en bacterias, plantas, invertebrados, vertebrados y mamíferos, con una alta conservación de la secuencia de aminoácidos . El alto grado de conservación de la secuencia de aminoácidos sugiere la naturaleza crucial de ADA en la ruta de recuperación de purina.
Principalmente, la ADA en humanos está involucrada en el desarrollo y mantenimiento del sistema inmunológico. Sin embargo, también se ha observado una asociación de ADA con la diferenciación de las células epiteliales , la neurotransmisión y el mantenimiento de la gestación . También se ha propuesto que el ADA, además de la degradación de la adenosina, estimula la liberación de aminoácidos excitadores y es necesario para el acoplamiento de los receptores de adenosina A1 y las proteínas G heterotriméricas . La deficiencia de adenosina desaminasa conduce a fibrosis pulmonar, lo que sugiere que la exposición crónica a altos niveles de adenosina puede exacerbar las respuestas inflamatorias en lugar de suprimirlas. También se ha reconocido que la proteína y la actividad de la adenosina desaminasa están reguladas positivamente en corazones de ratón que sobreexpresan HIF1α , lo que explica en parte los niveles atenuados de adenosina en corazones que expresan HIF-1α durante el estrés isquémico .
Patología
Algunas mutaciones en el gen de la adenosina desaminasa hacen que no se exprese. La deficiencia resultante es una causa de inmunodeficiencia combinada grave (SCID), en particular de herencia autosómica recesiva. Los niveles deficientes de ADA también se han asociado con inflamación pulmonar, muerte de las células tímicas y señalización defectuosa del receptor de células T.
Por el contrario, las mutaciones que provocan la sobreexpresión de esta enzima son una de las causas de la anemia hemolítica .
Existe alguna evidencia de que un alelo diferente (ADA2) puede conducir al autismo .
Los niveles elevados de ADA también se han asociado con el SIDA .
Isoformas
Hay 2 isoformas de ADA: ADA1 y ADA2.
- ADA1 se encuentra en la mayoría de las células del cuerpo, particularmente en linfocitos y macrófagos , donde está presente no solo en el citosol y el núcleo, sino también como ectoforma en la membrana celular unida a la dipeptidil peptidasa-4 (también conocida como CD26). ADA1 participa principalmente en la actividad intracelular y existe tanto en forma pequeña (monómero) como en forma grande (dímero). La interconversión de formas pequeñas a grandes está regulada por un "factor de conversión" en el pulmón.
- La ADA2 se identificó por primera vez en el bazo humano. Posteriormente se encontró en otros tejidos, incluido el macrófago, donde coexiste con ADA1. Las dos isoformas regulan la proporción de adenosina a desoxiadenosina potenciando la destrucción de parásitos. El ADA2 se encuentra predominantemente en el plasma y suero humanos y existe únicamente como un homodímero.
Significación clínica
La ADA2 es la forma predominante presente en el plasma sanguíneo humano y aumenta en muchas enfermedades, particularmente aquellas asociadas con el sistema inmunológico: por ejemplo, artritis reumatoide , psoriasis y sarcoidosis . La isoforma plasmática de ADA2 también aumenta en la mayoría de los cánceres. ADA2 no es ubicuo pero coexiste con ADA1 solo en monocitos-macrófagos.
La ADA plasmática total se puede medir mediante cromatografía líquida de alta resolución o técnicas enzimáticas o colorimétricas. Quizás el sistema más simple es la medición del amoníaco liberado de la adenosina cuando se descompone en inosina. Después de la incubación del plasma con una solución tamponada de adenosina, el amoníaco se hace reaccionar con un reactivo de Berthelot para formar un color azul que es proporcional a la cantidad de actividad enzimática. Para medir ADA2, se añade eritro-9- (2-hidroxi-3-nonil) adenina (EHNA) antes de la incubación para inhibir la actividad enzimática de ADA1. Es la ausencia de ADA1 lo que causa SCID .
La ADA también se puede utilizar en el estudio de derrames pleurales linfocíticos o ascitis peritoneal , ya que tales muestras con niveles bajos de ADA excluyen esencialmente la tuberculosis de la consideración.
Los derrames pleurales de tuberculosis ahora se pueden diagnosticar con precisión mediante un aumento de los niveles de adenosina desaminasa en el líquido pleural, por encima de 40 U por litro.
La cladribina y la pentostatina son agentes antineoplásicos utilizados en el tratamiento de la leucemia de células pilosas ; su mecanismo de acción es la inhibición de la adenosina desaminasa.
Ver también
Referencias
Otras lecturas
- da Cunha JG (1992). "[Adenosina desaminasa. Una enzima pluridisciplinaria]". Acta Médica Portuguesa . 4 (6): 315-23. PMID 1807098 .
- Franco R, Casadó V, Ciruela F, Saura C, Mallol J, Canela EI, Lluis C (julio de 1997). "Adenosina desaminasa de superficie celular: mucho más que una ectoenzima". Avances en neurobiología . 52 (4): 283–94. doi : 10.1016 / S0301-0082 (97) 00013-0 . PMID 9247966 . S2CID 40318396 .
- Valenzuela A, Blanco J, Callebaut C, Jacotot E, Lluis C, Hovanessian AG, Franco R (1997). "La gp120 de la envoltura del VIH-1 y las partículas virales bloquean la unión de la adenosina desaminasa a la CD26 humana". Avances en Medicina y Biología Experimental . 421 : 185–92. doi : 10.1007 / 978-1-4757-9613-1_24 . ISBN 978-1-4757-9615-5. PMID 9330696 .
- Moriwaki Y, Yamamoto T, Higashino K (octubre de 1999). "Enzimas involucradas en el metabolismo de las purinas: una revisión de la localización histoquímica y las implicaciones funcionales". Histología e Histopatología . 14 (4): 1321–40. PMID 10506947 .
- Hirschhorn R (1993). "Identificación de dos nuevas mutaciones sin sentido (R156C y S291L) en dos pacientes con ADA-SCID inusuales para la respuesta a la terapia con exanguinotransfusiones parciales". Mutación humana . 1 (2): 166–8. doi : 10.1002 / humu.1380010214 . PMID 1284479 . S2CID 44617309 .
- Berkvens TM, van Ormondt H, Gerritsen EJ, Khan PM, van der Eb AJ (agosto de 1990). "Eliminación idéntica de 3250 pb entre dos repeticiones AluI en los genes ADA de pacientes ADA-SCID no relacionados". Genómica . 7 (4): 486–90. doi : 10.1016 / 0888-7543 (90) 90190-6 . PMID 1696926 .
- Aran JM, Colomer D, Matutes E, Vives-Corrons JL, Franco R (agosto de 1991). "Presencia de adenosina desaminasa en la superficie de células sanguíneas mononucleares: localización inmunoquímica mediante microscopía óptica y electrónica" . La Revista de Histoquímica y Citoquímica . 39 (8): 1001–8. doi : 10.1177 / 39.8.1856451 . PMID 1856451 .
- Bielat K, Tritsch GL (abril de 1989). "Actividad ectoenzimática de la adenosina desaminasa de eritrocitos humanos". Bioquímica molecular y celular . 86 (2): 135–42. doi : 10.1007 / BF00222613 . PMID 2770711 . S2CID 20850552 .
- Hirschhorn R, Tzall S, Ellenbogen A, Orkin SH (febrero de 1989). "Identificación de una mutación puntual que da como resultado una adenosina desaminasa (ADA) termolábil en dos niños no emparentados con deficiencia parcial de ADA" . La Revista de Investigación Clínica . 83 (2): 497–501. doi : 10.1172 / JCI113909 . PMC 303706 . PMID 2783588 .
- Murray JL, Perez-Soler R, Bywaters D, Hersh EM (enero de 1986). "Disminución de la actividad de adenosina desaminasa (ADA) y 5'nucleotidasa (5NT) en células T de sangre periférica en la enfermedad de Hodgkin". Revista estadounidense de hematología . 21 (1): 57–66. doi : 10.1002 / ajh.2830210108 . PMID 3010705 . S2CID 25540139 .
- Wiginton DA, Kaplan DJ, States JC, Akeson AL, Perme CM, Bilyk IJ, Vaughn AJ, Lattier DL, Hutton JJ (diciembre de 1986). "Secuencia completa y estructura del gen de la adenosina desaminasa humana". Bioquímica . 25 (25): 8234–44. doi : 10.1021 / bi00373a017 . PMID 3028473 .
- Akeson AL, Wiginton DA, Dusing MR, Estados JC, Hutton JJ (noviembre de 1988). "Alelos de adenosina desaminasa humana mutantes y su expresión por transfección en fibroblastos" . La Revista de Química Biológica . 263 (31): 16291–6. doi : 10.1016 / S0021-9258 (18) 37591-4 . PMID 3182793 .
- Glader BE, Backer K (febrero de 1988). "Actividad elevada de adenosina desaminasa de glóbulos rojos: un marcador de eritropoyesis desordenada en anemia de Diamond-Blackfan y otras enfermedades hematológicas". Revista británica de hematología . 68 (2): 165–8. doi : 10.1111 / j.1365-2141.1988.tb06184.x . PMID 3348976 . S2CID 44789636 .
- Petersen MB, Tranebjaerg L, Tommerup N, Nygaard P, Edwards H (febrero de 1987). "Nueva asignación del locus del gen de la adenosina desaminasa al cromosoma 20q13 X 11 mediante el estudio de un paciente con deleción intersticial 20q" . Revista de Genética Médica . 24 (2): 93–6. doi : 10.1136 / jmg.24.2.93 . PMC 1049896 . PMID 3560174 .
- Orkin SH, Goff SC, Kelley WN, Daddona PE (abril de 1985). "Expresión transitoria de ADNc de adenosina desaminasa humana: identificación de un clon no funcional resultante de una sustitución de un solo aminoácido" . Biología Molecular y Celular . 5 (4): 762–7. doi : 10.1128 / mcb.5.4.762 . PMC 366780 . PMID 3838797 .
- Valerio D, Duyvesteyn MG, Dekker BM, Weeda G, Berkvens TM, van der Voorn L, van Ormondt H, van der Eb AJ (febrero de 1985). "Adenosina desaminasa: caracterización y expresión de un gen con un promotor notable" . El diario EMBO . 4 (2): 437–43. doi : 10.1002 / j.1460-2075.1985.tb03648.x . PMC 554205 . PMID 3839456 .
- Bonthron DT, Markham AF, Ginsburg D, Orkin SH (agosto de 1985). "Identificación de una mutación puntual en el gen de la adenosina desaminasa responsable de la inmunodeficiencia" . La Revista de Investigación Clínica . 76 (2): 894–7. doi : 10.1172 / JCI112050 . PMC 423929 . PMID 3839802 .
- Daddona PE, Shewach DS, Kelley WN, Argos P, Markham AF, Orkin SH (octubre de 1984). "Adenosina desaminasa humana. ADNc y secuencia completa de aminoácidos primarios" . La Revista de Química Biológica . 259 (19): 12101–6. doi : 10.1016 / S0021-9258 (20) 71325-6 . PMID 6090454 .
- Valerio D, Duyvesteyn MG, Meera Khan P, Geurts van Kessel A, de Waard A, van der Eb AJ (noviembre de 1983). "Aislamiento de clones de cDNA para adenosina desaminasa humana". Gene . 25 (2–3): 231–40. doi : 10.1016 / 0378-1119 (83) 90227-5 . PMID 6198240 .
enlaces externos
- Ubicación del gen humano ADA en UCSC Genome Browser .
- Detalles del gen humano ADA en UCSC Genome Browser .
- PDBe-KB proporciona una descripción general de toda la información de estructura disponible en el PDB para la desaminasa de adenosina humana
- PDBe-KB proporciona una descripción general de toda la información de estructura disponible en el PDB para la desaminasa de adenosina de ratón









